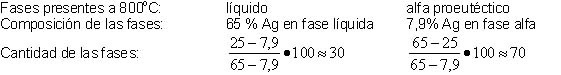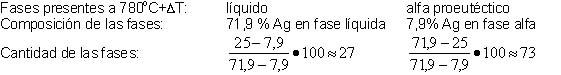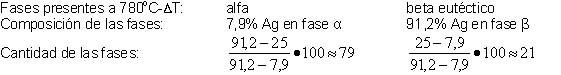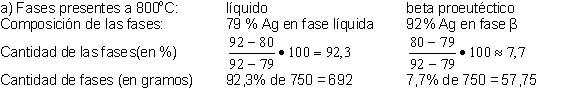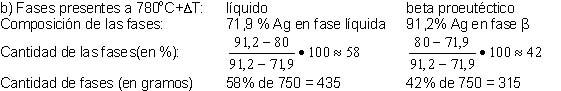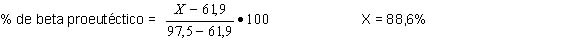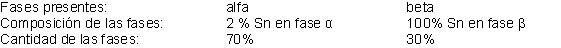2.
Actividades Diagramas
de fases

Actividad 2.1
a) Qué es
un diagrama de
fases? Qué información puede extraerse de ellos?
b) Diagrama de fases de una sustancia pura.
Aleaciones
metálicas.
Definición y utilidad.
Actividad 2.3
a) ¿Qué
es un sistema de aleación
isomorfa binaria?
b)
Poner un ejemplo de un sistema
isomorfo de aleación binaria y comentar su diagrama de fase.
Actividad 2.4
a) Cuáles son las cuatro
reglas de Hume-Rothery para la solubilidad en
estado sólido de un elemento en otro?
b) En la
tabla inferior se
muestran un número de elementos con su
estructura cristalina y radio atómico. ¿Qué parejas se espera que
tendrán solubilidad total en estado sólido entre sí?
Actividad 2.5
Describir el proceso
de construcción de un diagrama de fases isomorfo
binario.
Actividad 2.6
Considerar una aleación del
70% en peso de Ni y 30% en peso de Cu.
a) Realizar un
análisis de fases a 1.500°C y a 1350°C,
suponiendo
condiciones de equilibrio. En el análisis de fases debe incluirse las
siguientes cuestiones: (i)Fases presentes. (ii) Composición química de
cada fase (iii) Cantidades presentes de cada fase.
b) Esquematizar la
microestructura de la aleación a cada una de las
temperaturas anteriores utilizando campos microscópicos circulares.
Actividad 2.7
Comentar el diagrama de
fases plomo-estaño de la figura 2.6
Actividad 2.8
Considerar el
diagrama de
fases eutéctico binario cobre-plata de la figura
2.7
a) Realizar un
análisis de fases de una aleación del 75% en peso de Cu-25%
en peso de Ag a las temperaturas de 1.000 °C, 800oC, 780°C+∆T y a
780°C-∆T, suponiendo condiciones
de
equilibrio. En el análisis de fases
debe incluirse las siguientes cuestiones: (i)Fases presentes. (ii)
Composición química de cada fase (iii) Cantidades presentes de cada
fase.
b) Esquematizar la
microestructura de la aleación a cada una de las
temperaturas anteriores utilizando campos microscópicos circulares.
Actividad 2.9
Si 750g de una
aleación del 80% en peso de Ag-20% en peso de Cu se
enfría lentamente desde 1000°C hasta
justo por debajo de 780°C (ver
figura 2.7)
a) ¿Cuántos gramos de líquido y beta
proeutéctico hay presentes a 80°C?
b) ¿Cuántos gramos de líquido y beta
proeutéctico hay presentes a 78°C+∆T?1
c) ¿Cuántos gramos de alfa y beta hay
presentes en la estructura eutéctica a 78°C-∆T?
Actividad 2.10
Una aleación de Pb-Sn
consta de un 75% en peso de beta proeutéctico y
un 25% de alfa+beta eutéctico a 183°C-∆T.
Calcular la composición promedio de esta aleación.
Actividad 2.11
Una aleación de Pb-Sn contiene un 30% en peso de beta y un 70% de alfa
a 50°C. ¿Cuál
es la composición media de Pb y Sn en esta aleación?
Resolución de las actividades
a) Qué es un diagrama de
fases? Qué información puede extraerse de ellos?
b) Diagrama de fases de una sustancia pura.
a)
Los diagramas de fases son representaciones gráficas –a
varias
temperaturas, presiones y composiciones- de las fases que están
presentes en un sistema de materiales. Los diagramas de fases se
realizan mediante condiciones de equilibrio (enfriamiento lento) y son
utilizados para entender y predecir muchos aspectos del comportamiento
de los materiales.
Parte de la información que se puede obtener a partir de
ellos es la siguiente:
- Fases presentes a diferentes composiciones y
temperaturas.
- Solubilidad de un elemento o compuesto en otro.
- Temperatura a la cual una aleación que se deja
enfriar empieza a solidificar así como el rango de temperaturas en el
que tiene lugar la solidificación.
- Temperatura a la que se funden o empiezan a
fundirse las distintas fases.
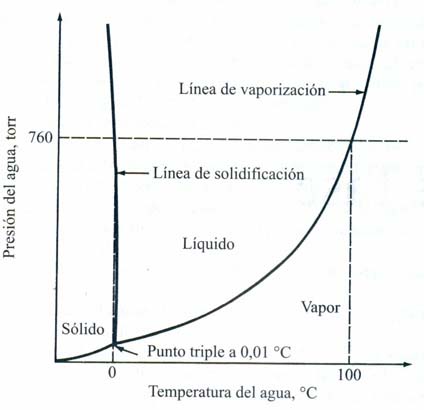
b) La
figura 2.1 muestra el diagrama de fases presión-temperatura del
agua. Una sustancia pura como el agua puede existir en fase sólida,
líquida o gaseosa en función de las condiciones de presión y
temperatura. En el diagrama se observa un punto triple a baja presión
(4579 torr) y baja temperatura (0,0098°C) en el que coexisten las fases
sólida, líquida y gaseosa del agua. Las fases líquida y gaseosa existen
a lo largo de la línea de vaporización; las fases líquida y sólida
existen a lo largo de la línea de solidificación. Estas líneas son
líneas de equilibrio entre las dos fases.
A presión
constante y a medida que aumenta la temperatura el agua pasa
de la fase sólida a la fase líquida. La temperatura en la que tiene
lugar este cambio de fase es la temperatura de fusión. Si continua
aumentando la temperatura habrá un segundo cambio de fase en el que el
agua pasa de líquido a vapor, es la temperatura de vaporización. La
temperatura de fusión y vaporización coincide para varias presiones con
la línea de solidificación y vaporización respectivamente.
Figura 2.1
Diagrama de equilibrio de fases para el agua pura
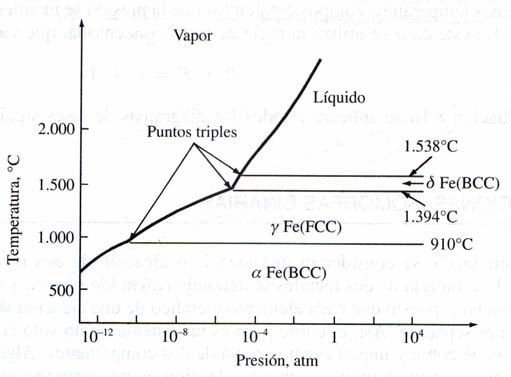
La figura 2.2
muestra el diagrama de fases presión-temperatura del hierro puro. El
hierro tiene a diferencia del agua tres fases sólidas separadas y
distintas: hierro alfa, hierro gamma y hierro delta. En el diagrama se
observan tres puntos triples en los que coexisten tres fases
diferentes: (1) líquido, vapor y Fe δ; (2) vapor, Fe δ y Fe γ; y (3)
vapor, Fe γ y Fe α.
Para una presión constante de 1 atm, el hierro pasa de la
fase líquida a la fase de Fe δ a la temperatura de fusión de 1.539°C.
Si continua el enfriamiento de la muestra y a 1.394°C
un segundo cambio
de fase producirá la transformación de la forma cristalina del Fe δ a
Fe γ. A 910°C se produce
el cambio de fase a Fe α que se mantendrá
hasta llegar a temperatura ambiente.
Figura 2.2
Diagrama de equilibrio de fases para el hierro puro.
Aleaciones metálicas.
Definición y utilidad.
Los metales
se caracterizan, en general, por tener una elevada
conductividad (eléctrica y térmica), resistencia mecánica, por ser
opacos, fundir a temperaturas elevadas, etc. Estas y otras propiedades
hacen de los metales los materiales más comúnmente utilizados en la
industria. No obstante, pocas veces se utilizan los metales en estado
puro, normalmente se mezclan con otros metales o elementos no metálicos
formando aleaciones.
Las aplicaciones técnicas de los metales exigen
frecuentemente que se
les otorguen unas propiedades diferentes de las originarias. A veces se
desea obtener una dureza y una resistencia mecánica mayor;
otras veces, una mayor plasticidad que facilite la conformación;
algunas veces se desea una mayor resistencia a la corrosión, etc. La
formación de aleaciones permite modificar las propiedades de los
metales: la resistencia mecánica de los metales mejora cuando son
aleados.
Una aleación metálica es un producto obtenido a partir de la
unión de
dos o más elementos químicos (como mínimo uno de los dos debe ser un
metal) y que, una vez formado, presenta las características propias de
un metal.
La fabricación de aleaciones puede llegar a ser un proceso
complejo
dependiendo del número de constituyentes de la aleación que deban de
añadirse al metal base (componente mayoritario) y de su proporción.
Para conocer el comportamiento de la mezcla de acuerdo con las
proporciones de los constituyentes de la aleación presentes, se
utilizan los diagramas de equilibrio o diagramas de fase. Cuando se
estudian aleaciones binarias (mezcla de dos metales) se construyen
diagramas temperatura-composición en los que la presión se mantiene
constante, normalmente a 1 atm. En dichos diagramas se representa la
temperatura en el eje de ordenadas y la composición de la aleación, en
tanto por ciento, en el de abcisas.
La constitución de una aleación a una determinada
temperatura queda
determinada por las fases presentes, la fracción en peso de cada una de
ellas y por su composición. La estructura de la aleación se describe
por el tamaño y forma de las fases presentes.

Actividad
2.3
a)
¿Qué es un sistema de aleación
isomorfa binaria?
b)
Poner un ejemplo de un sistema
isomorfo de aleación binaria y comentar su diagrama de fase.
a) Una mezcla
de dos metales se denomina aleación binaria y constituye
un sistema de dos componentes, puesto que cada elemento metálico de una
aleación se considera como un componente. El cobre puro es un sistema
de un solo componente mientras que una aleación de cobre y níquel es un
sistema de dos componentes.
En algunos sistemas binarios metálicos, los dos elementos
son
completamente solubles entre sí tanto en estado sólido como líquido. En
estos sistemas sólo existe un tipo de estructura cristalina para todas
las composiciones de los componentes y, por tanto, se les denomina
sistemas isomorfos.
b)
Un ejemplo importante de un sistema isomorfo de aleación binaria es
el sistema cobre-níquel. El cobre y el níquel tienen solubilidad total
tanto en estado líquido como sólido. En el diagrama de la figura 2.3 se
muestra el diagrama de fases de este sistema en el que se representa la
composición química de la aleación en tanto por ciento en peso en
abcisas y la temperatura en °C
en ordenadas. Este diagrama se ha
determinado bajo condiciones de enfriamiento lento y a presión
atmosférica y no tienen aplicación para aleaciones que sufren un
proceso de enfriamiento rápido. El área sobre la línea superior del
diagrama, línea de líquidus, corresponde a la región en la que la
aleación se mantiene en fase líquida. El área por debajo de la línea
inferior, línea sólidus, representa la región de estabilidad para la
fase sólida. Entre ambas líneas se representa una región bifásica en la
que coexisten las fases líquida y sólida. La cantidad de cada fase
presente depende de la temperatura y la composición química de la
aleación.
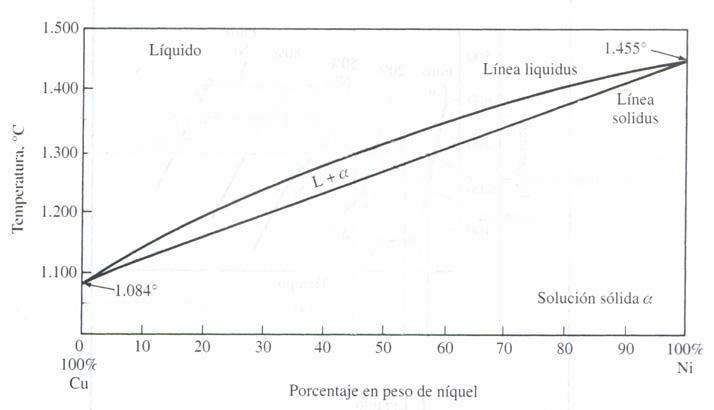
Figura 2.3
Diagrama de fases del cobre-níquel
Para una
determinada temperatura
puede obtenerse aleaciones totalmente en fase sólida, en fase
sólida+líquida y en fase totalmente líquida según la proporción de sus
componentes. De la misma manera, para una determinada proporción de la
mezcla, se puede definir una temperatura por debajo de la cual toda la
aleación se encuentre en fase sólida, un intervalo de temperaturas en
donde la aleación se encuentre en dos fases (sólida y líquida) y una
temperatura a partir de la cual toda la aleación esté líquida.
Actividad
2.4
a) Cuáles son las cuatro
reglas de Hume-Rothery para la solubilidad en
estado sólido de un elemento en otro?
b) En la tabla inferior se
muestran un número de elementos con su
estructura cristalina y radio atómico. ¿Qué parejas se espera que
tendrán solubilidad total en estado sólido entre sí?
|
|
Estructura
cristalina
|
Radio
atómico, nm
|
|
Estructura
cristalina
|
Radio
atómico, nm
|
|
Plata
|
FCC
|
0,144
|
Plomo
|
FCC
|
0,175
|
|
Paladio
|
FCC
|
0,137
|
Wolframio
|
BCC
|
0,137
|
|
Cobre
|
FCC
|
0,128
|
Rodio
|
FCC
|
0,134
|
|
Oro
|
FCC
|
0,144
|
Platino
|
FCC
|
0,138
|
|
Níquel
|
FCC
|
0,125
|
Tántalo
|
BCC
|
0,143
|
|
Aluminio
|
FCC
|
0,143
|
Potasio
|
BCC
|
0,231
|
|
Sodio
|
BCC
|
0,185
|
Molibdeno
|
BCC
|
0,136
|
a) Los
elementos que se disuelven completamente entre sí, normalmente
satisfacen una o más de las condiciones formuladas por el metalúrgico
inglés Hume-Rothery conocidas como reglas de solubilidad de sólidos de
Hume-Rothery:
- La estructura cristalina de
cada elemento de la solución sólida debe ser la misma.
- El tamaño de los átomos de
cada uno de los dos elementos no debe diferir en más de un 15%.
-
Los elementos no deben formar compuestos entre sí; esto es, no debería
haber diferencias apreciables entre las electronegatividades de ambos
elementos.
- Los elementos deben tener la
misma valencia.
No
todas las reglas de Hume-Rothery son aplicables siempre para todas las
parejas de elementos que presentan solubilidad total en estado sólido.
b)
Si atendemos a la primera de las reglas de Hume-Rothery se esperaría
que todos aquellos elementos con estructura cristalina FCC fueran
solubles entre sí como también todos aquellos con estructura cristalina
BCC.
Entre los elementos con estructura FCC
podríamos esperar con mayor seguridad que tuvieran solubilidad total
parejas de elementos como por ejemplo el rodio y el paladio, el cobre y
el níquel, el oro y el aluminio, el platino y el paladio, etc porque
tienen radios atómicos semejantes y el tamaño de sus átomos no supera
el 15% de diferencia.
Atendiendo a la tercera y
cuarta regla de Hume-Rothery y consultando la tabla periódica de los
elementos podríamos considerar que tienen solubilidad total parejas,
entre otras, rodio y paladio, cobre y níquel, y platino y paladio por
tener semejantes electronegatividades y actuar con la misma valencia.
Por la misma razón podría pensarse en la solubilidad entre los
elementos de estructura cristalina BCC molibdeno y wolframio.

Actividad
2.5
Describir el proceso de construcción de un diagrama de fases isomorfo
binario.
Los
diagramas de equilibrio para componentes que son completamente solubles
entre sí en estado sólido se construyen después de realizar una serie
de curvas de enfriamiento para distintas composiciones de la aleación.
Tomaremos como ejemplo el sistema Cu-Ni, y el proceso se muestra en la
figura 2.4.
Las curvas de enfriamiento para
metales puros muestran un valor fijo de temperatura de fusión: cuando
se enfría un metal puro y pasa del estado líquido al sólido, la
temperatura se mantiene constante mientras dura la solidificación (ver
línea AB para el Cu puro y CD para el Ni puro de la figura 2.4a). Una
vez solidificado el metal la temperatura continuará bajando, si nada se
lo impide, hasta llegar a temperatura ambiente.
La temperatura de fusión de una aleación binaria, en cambio,
no es
fija: depende de las proporciones de cada componente, y no tienen un
único valor sino que se representa mediante un intervalo. En la figura
2.4a, L1, L2, L3 y S1, S2, S3 representan el principio y el
final
respectivamente de la solidificación de una aleación de proporciones
80%Cu-20%Ni; %50%Cu-50%Ni y 20%Cu-80%Ni. Todas las composiciones de
aleaciones intermedias muestran curvas de enfriamiento similar. Cuántas
más curvas de enfriamiento intermedias se calculen mayor exactitud
tendrá el diagrama de fases que se construya.
El
sentido del diagrama de fases se obtiene al dibujar una línea que
relacione todos los puntos que corresponden al principio de la
solidificación (L1, L2, L3 …) y otra que una todos los puntos
en
los que se produce el final de la solidificación (S1, S2, S3 …). El
diagrama de fases real se determina representando gráficamente la
temperatura frente a la composición. Los puntos a representar se toman
de la serie de curvas de enfriamiento y se llevan al nuevo diagrama,
que resulta tal como se presenta en la figura 2.4b
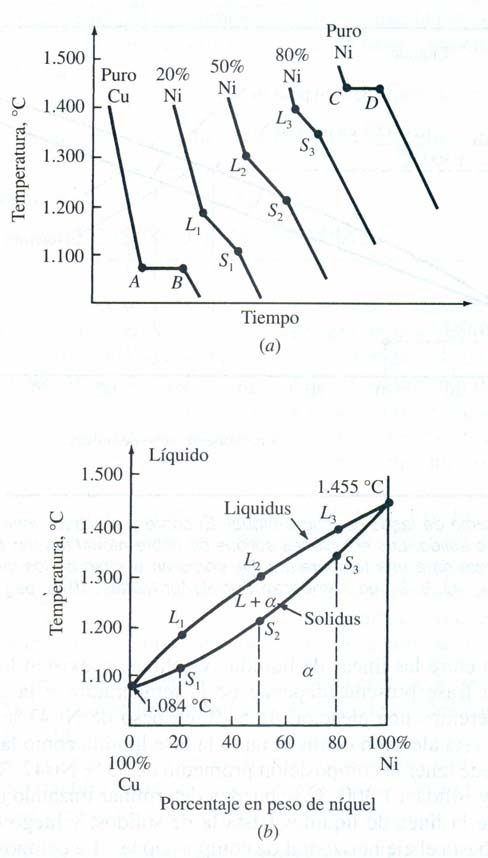
Figura
2.4 Construcción del
diagrama de fases en equilibrio
del Cu-Ni a partir de las curvas de enfriamiento líquido-sólido. a)
Curvas de enfriamiento b) Diagrama de fases en equilibrio
Actividad
2.6
Considerar una aleación del 70% en peso de Ni y 30% en peso de Cu.
a)
Realizar un análisis de fases a 1.500 °C y a 1350°C,
suponiendo
condiciones de equilibrio. En el análisis de fases debe incluirse las
siguientes cuestiones: (i)Fases presentes. (ii) Composición química de
cada fase (iii) Cantidades presentes de cada fase.
b)
Esquematizar la microestructura de la aleación a cada una de las
temperaturas anteriores utilizando campos microscópicos circulares.
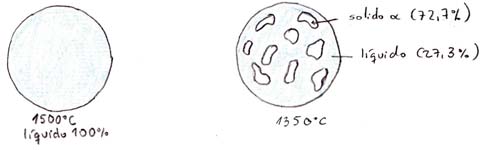
Figura 2.5
Diagrama de fases del cobre-níquel
El punto "a" del diagrama de fases representa una aleación Cu-70% en
peso de Ni a 1500°C,
A 1500 °C, el
100% en peso de la aleación es líquida (70% de Ni)
El punto "b" del diagrama de fases representa una aleación Cu-70% en
peso de Ni a 1350°C,

A 1350 °C un
27,3% de la aleación está en fase líquida (62% de Ni) y un
72,7% en fase alfa (73% de Ni).
Microestructura de la aleación
Actividad
2.7
Comentar el diagrama de fases plomo-estaño de la figura 2.6
Figura
2.6
Diagrama de fase en equilibrio Plomo-Estaño
Muchos
sistemas de aleaciones binarias tienen componentes que presentan
solubilidad en estado sólido limitada; El sistema Pb-Sn es uno de ellos.
Las áreas sombreadas (gris) de la derecha y de la izquierda
del diagrama, fase α y fase β, representan regiones de restricción de
solubilidad en estado sólido de los componentes de la aleación. La fase
α es una solución sólida rica en plomo que puede disolver un máximo de
19,2% en peso de estaño a 183°C.
La fase β es una solución sólida rica
en estaño que puede disolver un máximo de 2,5% en peso de plomo a
183oC. A medida que la temperatura disminuye por debajo de 183°C,
la
solubilidad máxima en estado sólido disminuye según indica la línea
solvus del diagrama.
La región superior del diagrama (azul) corresponde a la
región en la que la aleación se mantiene en fase líquida. El área por
debajo de la línea líquidus (verde) representa una región bifásica en
la que coexisten las fases líquida y sólida. La región inferior del
diagrama (amarilla) también es una región bifásica en la que coexisten
dos fases sólidas. La cantidad de cada fase presente depende de la
temperatura y la composición química de la aleación
La
aleación 1 del diagrama, de composición 61,9% de Sn y
38,1% de Pb es una aleación específica, llamada composición eutéctica,
que solidifica a temperatura más baja que todas las demás aleaciones.
La temperatura a la que tienen lugar esta solidificación es la
temperatura eutéctica (183°C).
Cuando una aleación de composición eutéctica, en estado
líquido, se enfría lentamente hasta alcanzar la temperatura eutéctica,
la fase líquida se transforma simultáneamente en dos formas sólidas no
solubles entre ellas (solución α y solución β), según la reacción:
Líquido(61,9%Sn)
=
Solución sólida α (19,2%Sn) + Solución sólida β (97,5%Sn)
En el punto eutéctico coexisten tres fases en equilibrio: fase líquido,
fase α y fase β
Una vez se ha
completado la reacción eutéctica, si la mezcla continúa enfriándose
hasta temperatura ambiente hay una disminución de la solubilidad en
estado sólido del soluto en las soluciones sólidas α y β, de manera que
la composición de estas soluciones variará con la temperatura, como
también lo hará la cantidad de cada una de la fases presentes.
La
aleación 2 del diagrama, de composición 40% Sn y 60%
Pb, representa una aleación que se deja enfriar a partir del estado
líquido a 300 °C
(punto "a") hasta la temperatura ambiente. A medida que
la temperatura desciende por debajo de 300°C
(punto "a") la aleación
permanecerá líquida hasta que la línea de liquidus resulte intersecada
en el punto "b" a una temperatura aproximada de 245°C,
a partir
de la cual parte del líquido empezará a precipitar en forma de solución
sólida α (fase sólida con un 12 % de Sn en disolución). La cantidad de
fase sólida α irá aumentando en detrimento de la fase líquida a medida
que la temperatura disminuya. En el punto "c" la solución sólida α
presenta aproximadamente un 15% de Sn en disolución y la fase líquida
aproximadamente un 48%. La cantidad de cada una de ellas es de 24% de
fase α y 76% de fase líquida (resultados obtenidos por aplicación de la
regla de la palanca). En el punto "d", justo por encima de 183°C,
la
cantidad de líquido que ha precipitado ya en forma de solución sólida α
es del 51%, quedando aún un 49% de la aleación en forma líquida. La
cantidad de Sn disuelto en la fase sólida es en este punto del 19,2% y
en la fase líquida del 61,9%. Un enfriamiento posterior, justo por
debajo de la temperatura eutéctica, producirá la solidificación de la
fase líquida remanente según la reacción eutéctica dando lugar a una
mezcla de fases sólidas α (19,2% Sn) + β (97,5% Sn), concretamente 73%
de fase α y 27% de fase β. Del 73% de fase α presente en este punto,
sólo un 22% es sólido formado mediante reacción eutéctica, el 51%
restante es sólido α proeutéctico formado antes de la reacción. El 27 %
del sólido β es eutéctico.

Actividad
2.8
Considerar el diagrama de
fases eutéctico binario cobre-plata de la figura 2.7
a)
Realizar un análisis de fases de una aleación del 75% en peso de Cu-25%
en peso de Ag a las temperaturas de 1.000 °C, 800oC, 780°C+∆T y a
780°C-∆T, suponiendo condiciones de
equilibrio. En el análisis de fases
debe incluirse las siguientes cuestiones: (i)Fases presentes. (ii)
Composición química de cada fase (iii) Cantidades presentes de cada
fase.
b) Esquematizar la
microestructura de la aleación a cada una de las
temperaturas anteriores utilizando campos microscópicos circulares.
Figura
2.7
Diagrama de fases cobre-plata
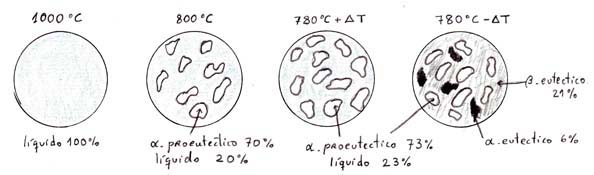
El punto "a"
del diagrama de fases representa una aleación Cu-25% en peso de Ag a
1000°C,
A
1000 °C, el 100%
en peso de la aleación es líquida (25% de Ag).
Aproximadamente a 950°C
empieza la solidificación de la aleación.
El punto "b" del diagrama de fases representa una aleación
Cu-25% en peso de Ag a 800°C,
A
800 °C un
30% de la aleación está en fase líquida (65% de Ag) y un 70% ha
solidificado en fase alfa (7,9% de Ag).
El
punto "c" del diagrama de fases representa una aleación Cu-25% en peso
de Ag justo por encima de la temperatura eutectoide (780°C+∆T),
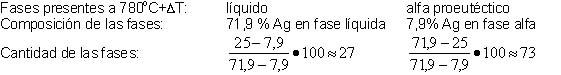
A 780°C+∆T
un
27% de la aleación está en fase líquida (71,9% de Ag) y un 73% en fase
alfa (7,9% de Ag).
El
punto "d" del diagrama de fases representa una aleación Cu-25% en peso
de Ag justo por debajo de la temperatura eutéctica (780°C-∆T),
en este
punto el 27% de la aleación que aún se encontraba en fase líquida en el
punto c ya ha solidificado.
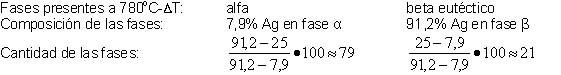
A
780°C-∆T un 79% de la
aleación está en fase α (7,9% de Ag) y un 21% en
fase β (91,2% de Ag). Del 79% de la fase α, sólo un 6% es alfa
eutéctico, el 73% restante es alfa proeutéctico formado antes de la
reacción eutéctica.
Microestructura de la aleación
Actividad
2.9
Si 750g de una aleación del 80% en peso de Ag-20% en peso de Cu se
enfría lentamente desde 1000°C hasta
justo por debajo de 780°C (ver
figura 2.7)
a) ¿Cuántos gramos de líquido y beta
proeutéctico hay presentes a 800°C?
b) ¿Cuántos gramos de líquido y beta
proeutéctico hay presentes a 780°C+∆T?
c) ¿Cuántos gramos de alfa y beta hay
presentes en la estructura eutéctica a 780°C-∆T?
A 1000°C
750g de la aleación son líquidos (80% de Ag) Un poco antes de alcanzar
los 800°C de temperatura,
empieza la solidificación.
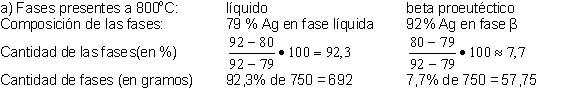
A 800 °C de los
750g de la aleación, 692,25g es fase líquida y 57,75g fase beta
proeutéctico.
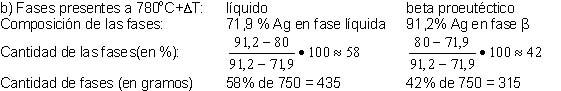
A 780°C+∆T de los 750g de
la aleación, 435g es fase líquida y 315g fase beta proeutéctico.

A 780°C-∆T de los 750g de
la aleación, 100,5g es alfa eutéctico y 649,5g es beta (315g beta
proeutéctico y 334,5g beta eutéctico)
Actividad
2.10
Una aleación de Pb-Sn consta de un 75% en peso de beta proeutéctico y
un 25% de alfa+beta eutéctico a 183°C-∆T.
Calcular la composición promedio de esta aleación.
La
presencia de beta proeutéctico en la aleación nos indica que la
composición que buscamos se encuentra hacia la derecha del punto
eutectico tal y como queda representado en el diagrama de fases de la
figura 2.8, es decir, se trata de una aleación hipereutéctica.
Figura 2.8
Diagrama de fases plomo-estaño
Justo por
encima de la temperatura eutéctica (a 183°C+∆T)
el porcentaje de beta proeutéctico es el mismo que justo por debajo de
esta temperatura (a 183°C-∆T).
Es por esta razón que aplicaré la regla de la palanca a 183°C+∆T
con el fin de calcular el % de estaño de la aleación.
Fases presentes a 183°C+∆T:
fase líquida (61,9 % Sn)
+ beta proeutéctico (97,5% Sn)
Llamando X al % en peso de Sn de la aleación:
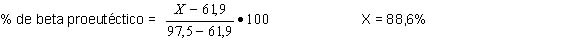
La composición de la aleación es de 88,6% en peso de estaño
y 11,4% en peso de plomo.
Actividad
2.11
Una aleación de Pb-Sn contiene un 30% en peso de beta y un 70% de alfa
a 50°C. ¿Cuál
es la composición media de Pb y Sn en esta aleación?
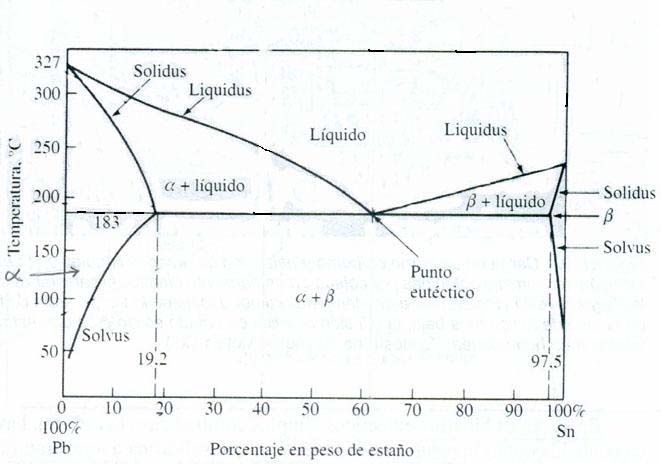
Figura 2.9
Diagrama de fases plomo-estaño
A 50°C
la cantidad de estaño disuelto en fase alfa es aproximadamente del 2%
(ver figura 2.9). La fase beta es 100% de estaño, no presenta Pb en
disolución.
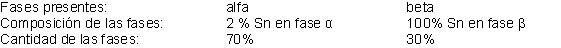
Llamando X al % en peso de estaño y aplicando la regla de la
palanca para la fase alfa:

La composición de la aleación es de 31,4% en peso de estaño
y 68,6% en peso de plomo.