

1. Actividades Estructura de los sólidos
Si los átomos o iones de un sólido están ordenados según una disposición que se repite en las tres dimensiones, forman un sólido que se dice posee estructura cristalina y es referido como sólido cristalino o material cristalino. Ejemplos de materiales cristalinos son los metales, las aleaciones, y algunos materiales cerámicos.
 Figura
1.1 (a) Red espacial de
un sólido cristalino. (b)
Celdilla unidad
con indicación de las constantes de red.
Figura
1.1 (a) Red espacial de
un sólido cristalino. (b)
Celdilla unidad
con indicación de las constantes de red.Actividad 1.2
¿Cuáles
son las 14
celdillas unidad de Bravais?
El número de redes espaciales no es infinita. Los cristalógrafos han mostrado que sólo existen siete sistemas cristalinos independientes posibles, que dan lugar a 14 redes espaciales, denominadas redes de Bravais. En la figura 1.2 se representan las celdillas unidad correspondientes a las 14 redes de Bravais. En la tabla 1.1 se dan los parámetros de la red necesarios para describir los distintos sistemas cristalinos, que definen el tamaño y la forma de cada celdilla unidad.
Si se analiza la tabla 1.1 y la figura 1.2 se observa que hay cuatro sistemas básicos de celdilla unidad: sencilla, centrada en el cuerpo, centrada en las caras y centrada en la base. En el sistema cúbico hay tres tipos posibles de celdilla unidad: cúbica sencilla, cúbica centrada en el cuerpo y cúbica centrada en las caras. En el sistema ortorrómbico hay los cuatro tipos posibles: ortorrómbico sencillo, ortorrómbico centrado en el cuerpo, ortorrómbico centrado en las bases y ortorrómbico centrado en las caras. El sistema tetragonal presenta dos tipos de celdillas posibles, tetragonal sencilla y tetragonal centrada en el cuerpo. El sistema monoclínico tiene celdillas unidad sencilla y centrada en la base. Los sistemas romboédrico, hexagonal y triclínico tienen sólo el tipo sencillo de celdilla unidad.
Tabla 1.1 Clasificación de redes espaciales en sistemas cristalinos
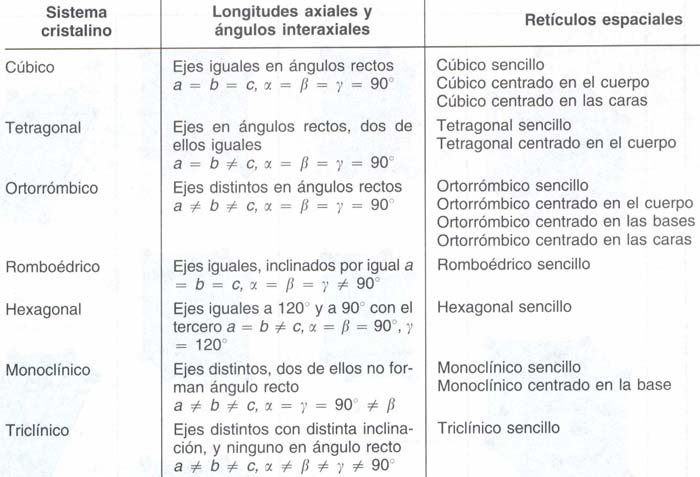
Figura 1.2 Las 14 celdillas unidad de Bravais agrupadas en sistemas cristalinos


Actividad
1.3
¿Cuáles son las tres
estructuras cristalinas más comunes de los metales? Indicar cinco
metales que
tengan cada una de estas estructuras cristalinas.
Los átomos en las estructuras cristalinas FCC y HCP están unidos del modo más compacto posible, el empaquetamiento es máximo. La estructura cristalina BCC no es una estructura totalmente compacta ya que los átomos aún podrían situarse más juntos.
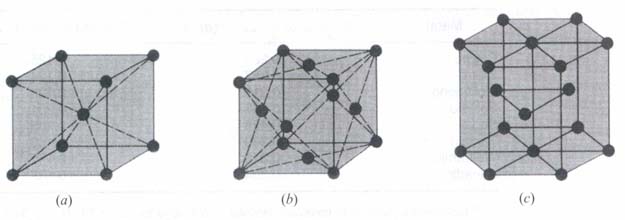
Metales como el cromo, el hierro, el molibdeno, el potasio y el sodio tienen estructura cristalina BCC a temperatura ambiente (20oC).
Muchos metales como el aluminio, el cobre, el hierro y el níquel a elevadas temperaturas (912 a 1394oC) cristalizan en una estructura cristalina FCC.
El cadmio, el zinc, el magnesio, el cobalto y el titanio son cinco metales con estructura cristalina HCP a temperatura ambiente (20oC)

Actividad
1.4
¿Qué
se entiende por
polimorfismo referido a metales? Exponer un ejemplo de metal alotrópico.
El polimorfismo o alotropía es el fenómeno por el cual muchos elementos y compuestos existen en más de una estructura cristalina bajo diferentes condiciones de temperatura y presión. Muchos metales de importancia industrial como el hierro, el titanio y el níquel sufren transformaciones alotrópicas a elevadas temperaturas a presión atmosférica.
Distintas formas alotrópicas de un elemento pueden presentar propiedades diferentes.
Normalmente las distintas formas alotrópicas se identifican con el nombre de las primeras letras griegas (alfa, beta, gamma, delta,…) según el orden creciente de temperaturas a las que se forman.
El hierro existe en las estructuras cristalinas BCC y FCC en el rango de temperaturas que va desde temperatura ambiente hasta la temperatura correspondiente a su punto de fusión, 1.539 oC. El hierro alfa (α) existe desde -273 a 912 oC y tiene la estructura cristalina BCC. El hierro gamma (γ) existe desde 912 a 1.394 oC y tiene la estructura cristalina FCC. El hierro delta (δ) existe desde 1.394 a 1.539 oC, que es el punto de fusión del hierro. La estructura cristalina del hierro delta es también BCC pero con una constante de red mayor que la del hierro alfa.
En la transformación por calentamiento de las formas cristalinas de hierro α a hierro γ se produce una disminución de volumen, mientras que al pasar de hierro γ a hierro α por enfriamiento, el volumen aumenta. Entre otros factores, estos cambios de volumen se deben a que la red FCC, presenta un empaquetamiento de los átomos más compacto que la red BCC.
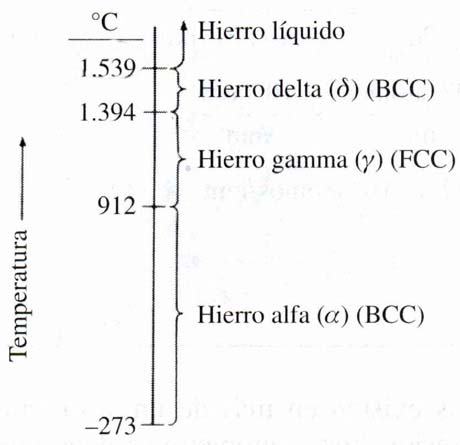 Figura
1.4
Formas cristalinas
alotrópicas del hierro en
distintos rangos de
temperatura, a presión atmosférica.
Figura
1.4
Formas cristalinas
alotrópicas del hierro en
distintos rangos de
temperatura, a presión atmosférica.