Forces intermoleculars.
Aspectes energètics.
Sòlids moleculars.
Justificació de les propietats anòmales de l'aigua i la seva importància per la vida
43.1 Forces intermoleculars
43.1.1 Forces dipol-dipol
43.1.2 Forces de dispersió de London
43.1.3 Forces dipol-dipol i forces de dispersió de London
43.1.4 Forces ió-dipol
43.1.5 Ponts d'hidrogen
43.2. L'aigua i la vida
43.2.1 El gel
43.2.2 Tensió superficial, Capil·laritat
43.2.3 Punt d'ebullició, capacitat calorífica
43.2.4 L'aigua, el dissolvent universal
43.2.5 Importància biològica de l'aigua
43.3 Sòlids moleculars
43.3.1 Cristalls moleculars
43.3.2 Els Polímers
43
Forces intermoleculars. Aspectes energètics. Sòlids moleculars. Justificació de les propietats anòmales de l'aigua i la seva importància per la vida
43.1 Forces intermoleculars
Les intensitats de les forces intermoleculars de diferents substàncies varien dins d'un marge molt ample, però generalment són molt més dèbils que els enllaços iònics i covalents.
La intensitat de les forces intermoleculars es veu reflectida en propietats tals com el punt de fusió i el punt d'ebullició. Com més fortes són les forces intermoleculars major són aquestes temperatures.
Hi ha tres tipus de forces d'atracció entre molècules neutres: forces dipol-dipol, forces de dispersió de London i forces de pont d'hidrogen. Aquestes forces també s'anomenen forces de Van der Waals. Un altre tipus de força d'atracció és la força ió-dipol, que és important en les solucions.
Com a grup, les forces intermoleculears solen tenir una intensitat inferior al 15% de la força dels enllaços covalents o iònics. Totes aquestes forces són de naturalesa electrostàtica.
43.1.1 Forces dipol-dipol
Existeixen forces dipol-dipol entre molècules neutres polars. Aquestes forces només són efectives quan les molècules estan molt juntes, és a dir, en líquids i en sòlids.

Les molècules de vegades adopten orientacions en les que hi ha forces de repulsió i de vegades d'altres en les que hi ha atracció. Dos molècules que s'atreuen, però, passen més temps juntes i per tant l'efecte global és d'atracció.
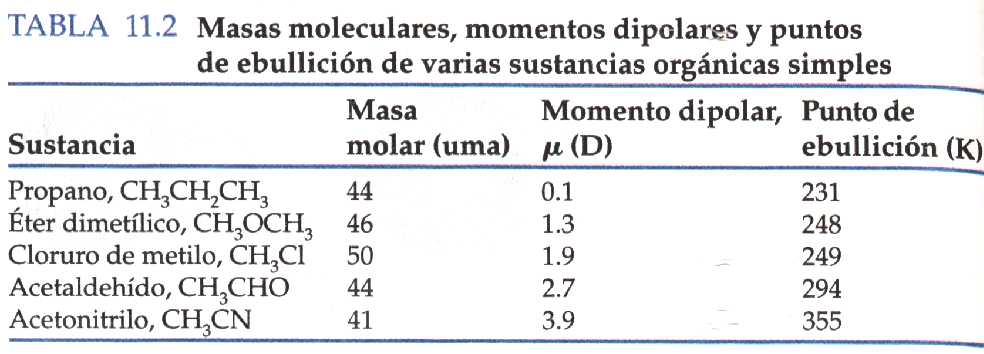
Quan es comparen molècules amb pesos moleculars semblants i grandària semblant s'observa que la intensitat de les atraccions intermoleculars augmenta a l'augmentar la polaritat. Fixem-nos, però que aquestes forces no deuen ser les úniques entre aquestes molècules, doncs fins i tot amb moments dipolars molt petits els punts d'ebullició són relativament alts.
43.1.2 Forces de dispersió de London
Fins i tot en molècules neutres i no polars hi ha forces d'atracció, doncs fins i tot gasos com l'oxigen i el nitrogen liqüen si se'ls sotmet a temperatures suficientment baixes.
Cap a l'any 1930, Fritz London se n'adonà de que el propi moviment dels electrons en un àtom o una molècula poden crear un moment dipolar instantani. Aquest moment dipolar instantani indueix un moment dipolar a l'altra molècula o àtom i es produeix una força neta d'atracció. Aquesta força atractiva s'anomena força de dispersió de London. Anàlogament a les forces dipol-dipol, aquestes forces es manifesten si les molècules són suficientment a prop.

Una propietat important de les molècules que determina la intensitat de les forces de dispersió és la seva polaritzabilitat. Com més gran és la polaritzabilitat, més gran és el dipol que una molècula pot induir en una molècula veïna i més grans són les forces de dispersió. La polaritzabilitat depèn dels àtoms que formen les molècules (com més grans acostumen a ser més polaritzables) i de la pròpia grandària de la molècula (com més gran és la molècula major és el nombre d'electrons lluny del nucli dels àtoms i per tant sensibles als camps elèctrics). Per tant, en general, com més gran és el pes molecular de les molècules major són les forces d'interacció de London.
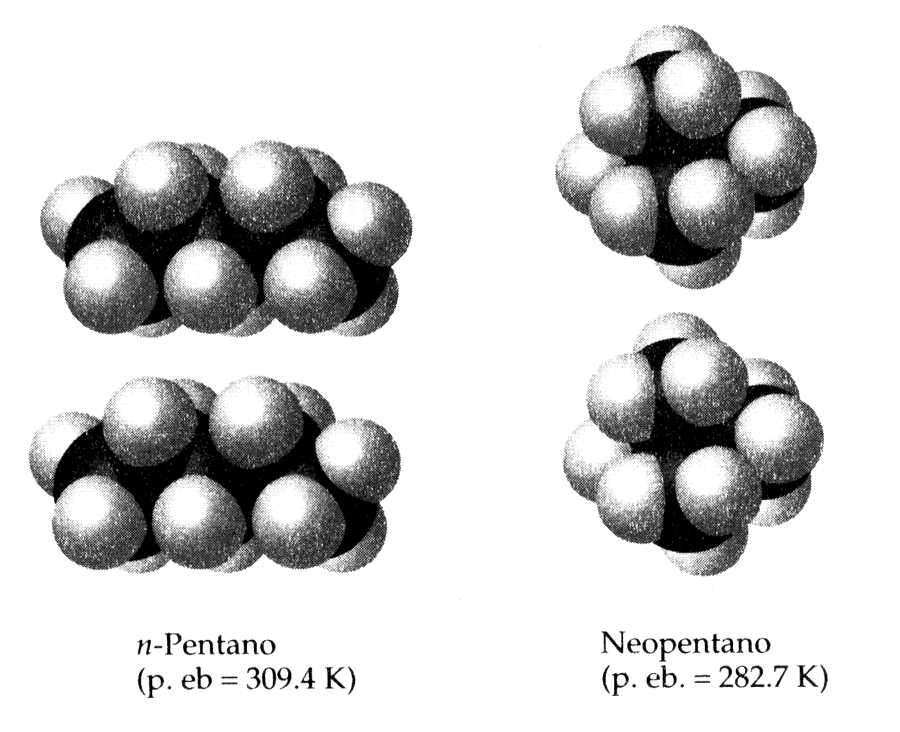
Un altre factor que també influeix en la polaritzabilitat, encara que generalment en menor mesura, és la pròpia geometria de la molècula. Si comparem molècules del mateix pes molecular amb geometries diferents s'observa que la presenta una forma més allargada té un punt d'ebullició superior a la que presenti una forma més esfèrica. Les molècules allargades poden apropar més els seus àtoms que les esfèriques. Un exemple: n-Pentà amb forma allargada Te = 309.4K; i Neopentà, de forma esfèrica Te = 282.7K
43.1.3 Forces dipol-dipol i forces de dispersió de London
Anem a comparar la intensitat de les forces dipol-dipol i les forces de dispersió de London. Les forces de dispersió de London ocorren entre totes les molècules. Aquestes forces de dispersió acostumen a ser més intenses que les forces dipol-dipol. Per exemple, en el HCl s'estima que les forces de dispersió són responsables del 80% de la força d'atracció entre aquestes molècules. Generalitzant, podem dir que:
Existeix una força ió-dipol entre un ió i la càrrega parcial d'un extrem d'una molècula polar. Les molècules polars són dipols; tenen un extrem positiu i un negatiu. Els ions positius són atrets cap a l'extrem negatiu d'un dipol i els ions negatius cap a l'extrem positiu. La magnitud de l'atracció augmenta a l'incrementar-se la càrrega de l'ió o la magnitud del moment dipolar. Les forces ió-dipol són importants en les solucions de substàncies iòniques en líquids polars. La interacció entre el solut iònic i el solvent s'anomena solvatació. Si el dissolvent és aigua s'anomena hidratació.
43.1.5 Ponts d'hidrogen
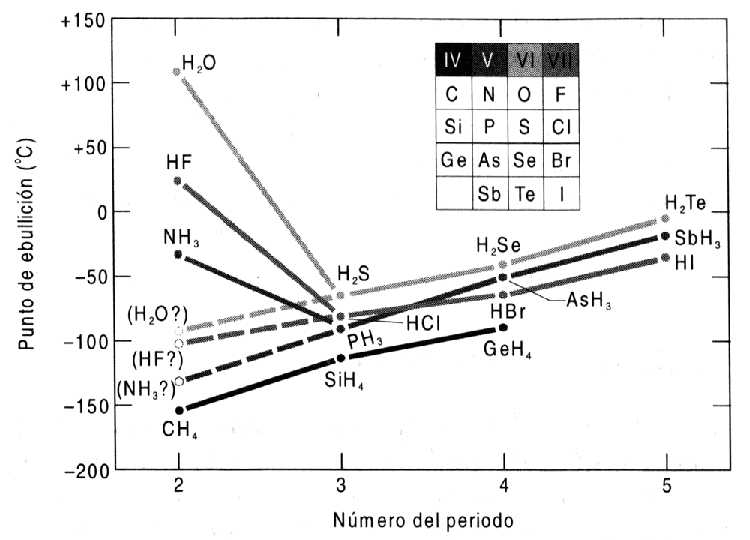
Quan s'estudien els hidrurs de diverses substàncies, s'observa que el H2O, el NH3 i el FH presenten punts d'ebullició molt més alts del que es podria esperar per extrapolació de les temperatures dels hidrurs dels elements del mateix grup. En els hidrurs de les substàncies del mateix grup que l'oxigen, el nitrogen o el fluor s'observa que els punts d'ebullició incrementen la temperatura amb l'increment de pes molecular, tal i com podríem esperar a partir del que ja hem indicat de les característiques de les forces d'interacció de London. Per explicar aquesta anomalia cal introduir un tipus d'interacció intermolecular d'una intensitat més gran que qualsevol de les anteriors: el pont d'hidrogen.
Els ponts d'hidrogen són un tipus d'atracció intermolecular electrostàtica que existeix entre l'àtom d'hidrogen que pertany a un enllaç polar, (sobre tot H-F, O-H i F-H) i un parell d'electrons no compartit d'un àtom electronegatiu proper d'una altra molècula (F, O, N).
El fluor, el nitrogen i l'oxigen són àtoms molt electronegatius i per tant els enllaços amb l'hidrogen són molt polars. L'àtom d'hidrogen no té electrons interns, per tant el costat positiu del dipol és pràcticament un protó, i per tant, aquesta càrrega positiva és atreta cap a la càrrega negativa d'un àtom electronegatiu d'una molècula propera. Com que l'hidrogen desproveït d'electrons és molt petit, es pot apropar molt a un parell d'electrons d'un àtom electronegatiu i interactuar fortament amb ells.
El moment dipolar en ordre creixent pels enllaços del N, O i F amb l'hidrogen és:
![]()
Per a que la interacció amb un àtom Y sigui màxima ha de posseir un parell d'electrons no compartit que atregui l'extrem positiu del dipol X-H. Aquest parell d'electrons no ha d'estar massa dispers per l'espai, perquè si no el dipol X-H no experimentarà una interacció forta. Per aquest motiu els ponts d'hidrogen no son molt forts si Y no és un àtom petit i molt electronegatiu, és a dir, fluor, oxigen o nitrogen. Entre aquests tres elements s'observa que els ponts d'hidrogen són més forts quan el parell d'electrons no és tret amb massa força cap el seu propi nucli. Per tant el nitrogen és millor donador del seu parell d'electrons que l'oxigen i l'oxigen millor que el fluor. Per a un enllaç X-H donat, la força dels ponts d'hidrogen augmenta en l'ordre
![]()
Si X i Y són el mateix àtom, l'energia dels ponts d'hidrogen varia aleshores com:
![]()
Si l'àtom Y té càrrega negativa, aleshores el pont d'hidrogen és extraordinàriament fort. El pont d'hidrogen entre F-H···F- correspon a 155 kJ/mol.
Les energies dels ponts d'hidrogen varien des de 5kJ/mol fins 25kJ/mol i per tant són força més petits que els enllaços químics ordinaris, però són molt més forts que qualsevol altra interacció intermolecular.
Els ponts d'hidrogen són de capital importància en Biologia.
Els ponts d'hidrogen són importants per estabilitzar l'estructura
de les proteïnes i del ADN. A més, són els responsables
d'una part molt important de les propietats de l'aigua, element essencial
per a la vida.
43.2. L'aigua i la vida
L'aigua té un seguit de propietats que la converteixen en una substància molt especial i de gran importància per al desenvolupament de la vida en el nostre planeta. Com ja hem comentat l'aigua està formada per molècules que estan subjectes a forces intermoleculars d'una gran intensitat degut als ponts d'hidrogen. Cada molècula d'aigua és susceptible d'establir 4 ponts d'hidrogen amb molècules veïnes, fet que reforça encara més la interacció a que està sotmesa cada molècula. Aquest fet justifica tot un seguit de propietats importants que es poden considerar anòmales al comparar-les amb substàncies d'estructura similar.
43.2.1 El gel
Si partim d'aigua a 100ºC i l'anem refredant, la seva densitat va disminuint fins als 4ºC, en els que la densitat és 1g/cm3. Si continuem disminuint la temperatura fins a 0ºC la densitat disminueix. La densitat del gel a 0ºC és de 0.917 g/cm3.
La baixa densitat del gel es pot entendre en termes de les interaccions dels ponts d'hidrogen entre les molècules d'aigua. Les interaccions en el líquid són de caràcter aleatori. En canvi, l'aigua, al congelar-se, les seves molècules adopten una disposició ordenada que dona lloc a una estructura menys densa. Aquesta estructura menys densa permet la màxima interacció de pont d'hidrogen entre les molècules d'aigua. Els ponts d'hidrogen controlen l'orientació de les molècules d'aigua en el gel. Cada molècula d'aigua es troba envoltada, en forma tetraèdrica per quatre molècules unides per ponts d'hidrogen. La distància O-H és de 1A i la distància O-H···O és de 1,8A, el que fa que la distància entre els àtoms d'oxigen sigui de 2.8ª. L'estructura cristal·lina resultant és hexagonal oberta.
Aquesta propietat de l'aigua té grans repercussions per als éssers vius. Com que el gel té menor densitat que l'aigua, el gel sura. Per tant, quan una massa gran d'aigua comença a congelar-se (un riu, un llac, etc) es cobreix amb una capa de gel que anirà augmentant de gruix a una velocitat molt lenta, degut a que el gel no és un bon conductor de l'escalfor. D'aquesta manera la part inferior de la capa de gel acostuma a romandre líquida i això permet als peixos i d'altres espècies sobreviure.
Un altre efecte important és l'erosió. El gel, a l'expandir-se ajuda a meteoritzar les roques. Aquest efecte afavoreix el desenvolupament de plantes colonitzadores en zones volcàniques o en zones on no hi ha sòl.
43.2.2 Tensió superficial, Capil·laritat
L'aigua té una tensió superficial molt elevada a causa de la forta atracció entre les seves molècules. Conseqüència d'això és que les gotes de pluja mantinguin una forma molt esfèrica i a més el seu impacte amb el terra tingui una eficàcia erosiva notable.
La tensió superficial és aprofitada per uns insectes anomenats "Zapateros", que viuen a la superfície de l'aigua.
Aquesta tensió superficial però, es pot veure superada per la presència de substàncies amb les que es puguin establir ponts d'hidrogen. Un exemple n'és el vidre, SiO2. El vidre conté una gran quantitat d'àtoms d'oxigen a la seva superfície, i per tant l'aigua tendeix a estendre-s'hi. Diem que l'aigua mulla el vidre. L'aigua col·locada en un recipient de vidre s'adhereix al vidre formant un menisc en forma de U pel mateix motiu.
Si col·loquem un tub de vidre de diàmetre molt petit (un capil·lar) en aigua, el líquid puja pel tub. D'aquest efecte en diem capil·laritat. Les forces d'adhesió entre el líquid i les parets del tub tendeixen a augmentar l'àrea superficial del líquid. La tensió superficial del líquid tendeix a reduir l'àrea. El líquid puja fins que les forces d'adhesió i cohesió s'equilibren amb la forca de la gravetat. L'acció capil·lar ajuda a que l'aigua i els nutrients dissolts pugin per les arrels i la tija de les plantes.
43.2.3 Punt d'ebullició, capacitat calorífica
Degut a la intensitat de les forces intermoleculars, l'aigua, a la pressió atmosfèrica, es manté líquida en un rang molt ample de temperatures, des dels 0ºC fins a 100ºC.
Degut també a les forces intermoleculars, el calor de vaporització és en comparació amb d'altres substàncies, molt alt. Aquest fet té una gran influència en el clima del planeta. L'aigua quan s'evapora (com per exemple en les regions equatorials del planeta) absorbeix de l'ambient grans quantitats de calor produint-se, doncs refredament. Quan l'aigua condensa es cedeix a l'entorn la mateixa quantitat de calor que s'havia absorbit abans. Això fa que l'aire humit i calent pugui arribar a alçades més elevades que l'aire calent i sec i justifica la grandària en alçada que prenen els núvols de desenvolupament vertical. Aquesta propietat de l'aigua l'utilitzen els mamífers per controlar la temperatura corporal. Quan s'ha d'alliberar calor el cos permet l'evaporació d'una quantitat més gran d'aigua. Si hem d'alliberar molta calor suem per fer aquest mecanisme encara més efectiu.
La capacitat calorífica de l'aigua és també molt elevada. Aquest fet és de vital importància per a l'estudi dels sistemes climàtics, doncs l'aigua actua com a moderador tèrmic: pot absorbir grans quantitats de calor amb un canvi relativament petit de temperatura i a l'inrevés. Com que la major part del nostre planeta està cobert per aigua, això assegura que les temperatures a la Terra no siguin tant extremes com en d'altres planetes. A les zones costaneres els climes són sempre més moderats pel mateix motiu. La roca sòlida té una capacitat calorífica molt més petita, justificant-se així les grans variacions tèrmiques pròpies del clima continental.
La capacitat calorífica de l'aigua també és important de forma directa per als éssers vius, doncs dificulta la variació de temperatura. Aquest fet és d'especial importància per als mamífers, que funcionen dins d'un marge de temperatures molt estret. Aquest fet també implica que elevar la temperatura del cos quan tenim febre suposa una despesa energètica important.
43.2.4 L'aigua, el dissolvent universal
L'aigua és un dels millors dissolvents que existeix a la natura. Aquesta propietat és deguda en part a que és una molècula amb un moment dipolar important i també a la seva facilitat per establir ponts d'hidrogen amb substàncies que també siguin sensibles a aquest tipus d'interacció. Per tant l'aigua pot dissoldre en quantitats considerables un ventall molt ampli de substàncies: substàncies iòniques, molècules polars i molècules no polars amb les que es puguin establir ponts d'hidrogen. Les dues últimes categories fa que l'aigua pugui dissoldre un ampli ventall de substàncies orgàniques importants per a la vida.
L'aigua també pot dissoldre en quantitats més petites, però relativament molt importants gasos, com per exemple l'oxigen i el nitrogen. Aquest poder de dissolució es deu a forces de dispersió de London i és important, doncs fa possible el desenvolupament d'organismes aerobis a l'interior dels oceans. Aquest fet té una gran transcendència en l'història evolutiva dels éssers vius.
43.2.5 Importància biològica de l'aigua
La importància biològica de que l'aigua pugui dissoldre un espectre tant ampli de substàncies és molt gran, doncs permet als organismes vius treballar amb un únic solvent. L'aigua és el principal component dels éssers vius. Constitueix del 50 al 90% de la massa dels organismes vius. El protoplasma, que és la matèria bàsica de les cèl·lules vives, consisteix en una dissolució de greixos, carbohidrats, proteïnes, sals y altres compostos químics similars en aigua. L'aigua actua com a dissolvent transportant, combinant i descomponent químicament aquestes substàncies. La sang dels animals i la saba de les plantes contenen una gran quantitat d'aigua, que serveix per a transportar els aliments i per a desfer-se dels residus. L'aigua és important en la descomposició metabòlica de molècules tant essencials com les proteïnes i els carbohidrats. Aquest procés, anomenat hidròlisi es produeix contínuament a les cèl·lules vives.
43.3 Sòlids moleculars
Els sòlids moleculars consisteixen en àtoms o molècules units per forces intermoleculars: forces dipol-dipol, forces de dispersió de London i ponts d'hidrogen. Com que aquestes forces són dèbils, els sòlids moleculars són tous i tenen punts de fusió relativament baixos (generalment menys de 200ºC). Quasi totes les substàncies que són gasos o líquids a temperatura ambient formen sòlids moleculars a temperatures baixes, com per exemple Ar, CH4, H2O i CO2.
Els sòlids moleculars acostumen a tenir una conductivitat tèrmica molt baixa i no són en estat pur no són conductors de l'electricitat. Els sòlids moleculars poden ser amorfs, cristal·lins o part amorf part cristal·lí.
43.3.1 Cristalls moleculars
L'energia d'enllaç és molt petita comparada amb cristalls iònics o cristalls amb enllaç covalent. Aquest tipus de cristalls tendeixen a ser volàtils i posseeixen punts de fusió i d'ebullició baixos. Els cristalls moleculars tendeixen a ser tous, compressibles i fàcilment deformables.
Els cristalls moleculars són, en general, bons aïllants de l'electricitat. Les molècules no tenen càrrega elèctrica neta i per tant no poden transportar electricitat. A més, com que el cristall es composa de molècules discretes, els electrons tendeixen a estar localitzats al voltant d'un grup específic de nuclis. Exemples: H2O, CO2, I2, naftalina, etc.
43.3.2 Els Polímers
Un tipus molt particular de sòlids moleculars són els polímers. Els polímers són molècules amb una massa molecular molt gran formats a partir de la unió (polimerització) de monòmers (molècules de pes molecular petit). Els polímers acostumen a ser molècules molt llargues que en alguns casos presenten ramificacions. Aquestes molècules interactuen entre si mitjançant forces intermoleculars com les que ja hem explicat (de vegades, però, també s'hi afegeixen substàncies que produeixen enllaços covalents entre les molècules, però ara exclourem aquesta possibilitat).
Molts polímers són en gran part materials amorfs (no cristal·lins). En lloc de tenir fases cristal·lines ben definides, amb punts de fusió definits, els polímers s'estoven dins d'un interval de temperatures. Molts polímers amorfs poden posseir determinades regions on les molècules estiguin disposades de forma regular. El grau d'aquest tipus d'ordenament s'anomena cristal·linitat del polímer. En les regions cristal·lines les forces intermoleculars són més fortes, doncs les cadenes de polímer es troben alineades. Conseqüència de la cristal·linitat és, doncs que el polímer esdevé més dens, més dur, menys soluble i més resistent a la calor. Un polímer cristal·lí pot ser molt dur, però també molt fràgil, per la qual cosa en molts casos s'evita una cristal·linitat excessiva; les zones amorfes permeten al polímer plegar-se sense trencar-se. Per a la fabricació de fibres, en canvi, es necessita la màxima cristal·linitat possible. De fet, les fibres sintètiques són polímers disposats en cristalls molt llargs.
Un exemple important de polímer és el polietilè, que és forma per la polimerització de molècules d'etilè. Les cadenes de polietilè interaccionen mitjançant forces d'interacció de London. En el mercat es distingeixen dues categories bàsiques de polietilè, el polietilè de baixa densitat LDPE i polietilè d'alta densitat HDPE. El LDPE està format per molècules amb una massa molecular al voltant de 104 uma i les cadenes de polímer presenten ramificacions. Aquestes ramificacions impedeixen la formació de regions cristal·lines i redueixen la densitat del material. El LDPE és apte per a fer-ne les bosses de plàstic que tots fem servir. El HDPE està format per cadenes amb una massa molecular superior, al voltant de 106 uma. Aquestes cadenes tenen poques ramificacions, la qual cosa en permet l'aparició de regions cristal·lines. El HDPE s'utilitza per a la fabricació d'envasos. També hi ha l'anomenat polietilè de pes molecular ultraalt UHMWPE, 6x106 uma fet de cadenes lineals que formen cristalls, la qual cosa li confereix una extraordinària resistència i es fa servir per l'elaboració de fibres per a xalecs antibales. És notable el fet de que les forces d'interacció entre les molècules de polietilè són forces d'interacció de London, que en principi són molt petites, però com que el pes molecular és tant elevat les forces d'atracció entre les molècules són globalment molt fortes.
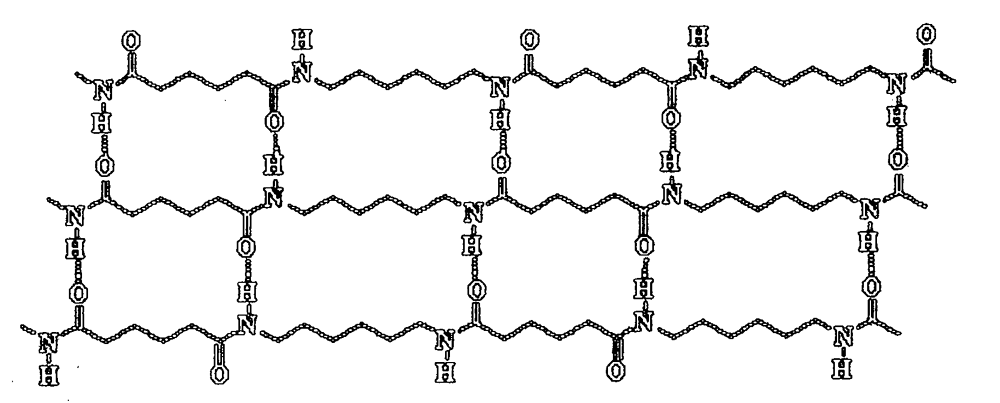
Els ponts d'hidrogen són fonamentals per explicar les propietats d'altres polímers que s'utilitzen per a l'obtenció de fibres. Exemples en són el kevlar, el nomex (protectors tèrmics dels bombers) i el nylon 6,6. Tots aquests polímers contenen grups amida (son poliamides), entre els que s'estableixen ponts d'hidrogen. Aquest tipus de polímers formen cristalls moleculars amb un grau de cristal·linitat molt elevat.
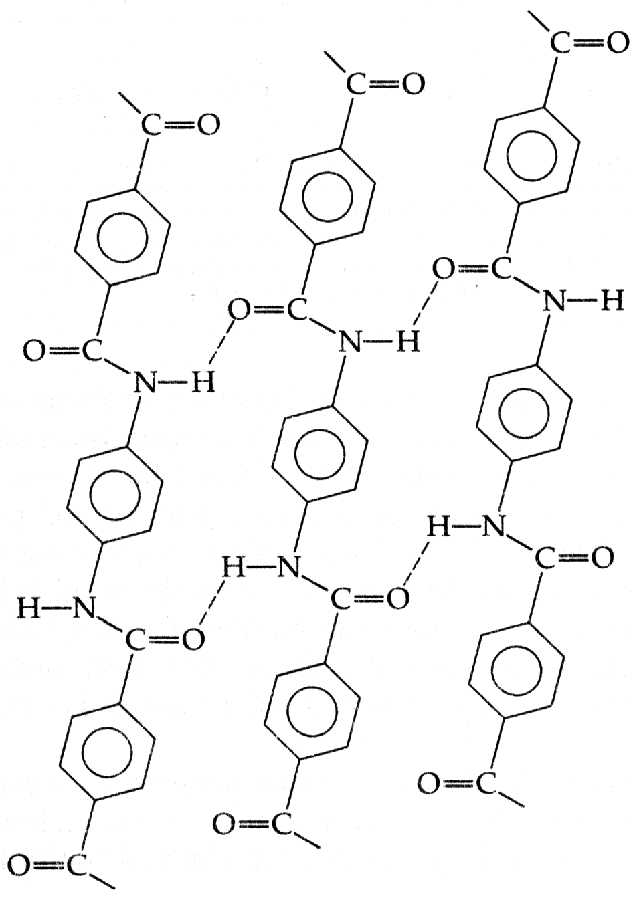
En el kevlar per exemple les cadenes individuals són invariablement lineals i estan unides per ponts d'hidrogen a les cadenes adjacents. Aquesta xarxa de ponts d'hidrogen fa que les molècules s'alineïn i formin una estructura de làmina. El kevlar té propietats excepcionals degut als forts enllaços en les cadenes de polímer individuals, la forta xarxa de ponts d'hidrogen en les làmines i la disposició regular de les làmines a les fibres.
Les cordes de kevlar han substituït les cordes d'acer en les plataformes petrolíferes marines i tenen 20 vegades la resistència de l'acer.
Hi ha altres fibres que també deuen les seves característiques als ponts d'hidrogen. Un altre exemple és nylon 6,6. En el nylon 6,6 els oxígens i els hidrògens dels grups amida formen ponts d'hidrogen que obliguen a les cadenes a alinear-se, la qual cosa possibilitat l'obtenció de fibres molt resistents.