TEMA 41
Lenllaç químic.
Aspectes energètics.
Classificació dels enllaços segons lelectronegativitat dels àtoms que el formen.
Estudi del tipus denllaç segons les propietats de les substàncies.
41.1
Lenllaç químic com una conseqüència del principi de mínima energia41.1.1
Formació de lenllaç41.1.2 Geometria Molecular
41.1.3 Polaritat de lenllaç
41.2 Classificació dels enllaços segons lelectronegativitat dels àtoms que el formen
41.3 Lenllaç iònic. Consideracions energètiques
41.3.1
Càlcul de lenergia de la xarxa cristal·lina41.3.2 Formació de lenllaç iònic
41.3.3 Efectes de la grandària dels ions sobre el nombre de coordinació, lestructura cristal·lina i sobre lenergia
41.4 Energies denllaç. Consideracions Termodinàmiques
41.4.1
Energies d'enllaç en substàncies covalents41.4.2 Energies reticulars
41.5 Estudi del tipus denllaç segons les propietats de les substàncies.
41.5.1
Substàncies Iòniques41.5.2 Substàncies Covalents
41
Lenllaç químic. Aspectes energètics. Classificació dels enllaços segons lelectronegativitat dels àtoms que el formen. Estudi del tipus denllaç segons les propietats de les substàncies.
41.1
Lenllaç químic com una conseqüència del principi de mínima energiaLexistència despècies poliatòmiques estables, ja siguin elementals o compostes, implica que els àtoms poden interactuar entre si per formar agregats que tenen una energia més baixa que els fragments separats. Quan aquesta disminució de lenergia excedeix 10kcal/mol dàtoms aproximadament, diem que existeixen enllaços químics doncs es produeixen espècies que tenen propietats químiques definides i característiques. Una reacció química és un procés que canvia un cert ordenament denllaços per un altre.
No només la pròpia formació de lenllaç sexplica en termes energètics, si no que totes les seves característiques: tipus denllaç, longitud denllaç i angles denllaç sexplica en termes de disposicions de mínima energia.
Cada àtom posseeix una determinada configuració electrònica, que sespecifica indicant quins orbitals atòmics ocupen els electrons. Els electrons de la capa més externa tenen energies més grans i reben el nom delectrons de valència. Els electrons de la capa de valència són els que intervenen en la formació de lenllaç entre dos o més àtoms i per tant són els que en determinen les propietats químiques.
Quan dos àtoms sapropen, resulta que la configuració de mínima energia deixa de ser la configuració electrònica que cada àtom presentava per separat. Els electrons de valència, que són els electrons més externs i més dèbilment lligats presenten energies relativament grans. Aquests electrons poden reduir la seva energia passant a ocupar uns nous orbitals, els orbitals moleculars que donen lloc a la formació del que sanomena enllaç covalent.
41.1.1
Formació de lenllaçHi ha vàries descripcions possibles de lenllaç covalent. La més senzilla de totes és lanomenada teoria de lenllaç de valència. En aquest model, els orbitals moleculars es formen per la superposició (suma) de dos orbitals de valència de dos àtoms. Això implica una acumulació de densitat electrònica entre dos nuclis. Aquest fet és duna importància fonamental. Lenergia potencial del sistema és més baixa quan els electrons són molt a prop de qualsevol dels dos nuclis o quan són en una regió que està relativament a prop dels dos nuclis alhora. Per tant locupació dorbitals moleculars per dos electrons permet disminuir lenergia total de la molècula, i per tant, es forma un enllaç. És en aquest sentit doncs que és possible afirmar que un enllaç suposa la compartició duna parella delectrons per dos nuclis.

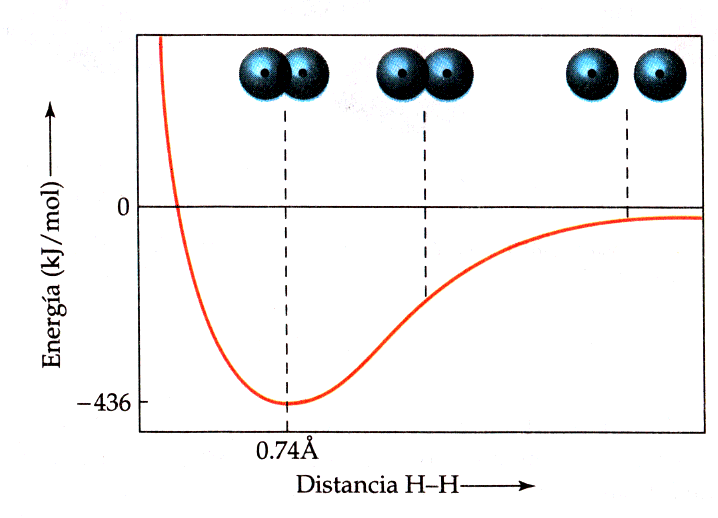
Sempre hi ha una distància òptima entre els dos nuclis enllaçats en qualsevol enllaç covalent. A mesura que els àtoms sapropen augmenta la superposició, augmenta la densitat electrònica entre els nuclis i lenergia disminueix fins a un cert mínim que anomenem energia denllaç. La distància internuclear en la que lenergia és mínima representa la longitud denllaç. Si els nuclis sapropen més apareixen forces de repulsió electrostàtiques que fan que lenergia pugi ràpidament. Així doncs, la longitud denllaç correspon a un equilibri entre forces datracció entre càrregues diferents (electrons i nuclis) i forces de repulsió entre càrregues iguals (electró-electró i nucli-nucli).
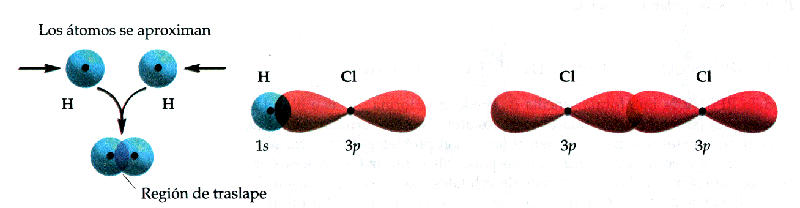
Anem a veure algun exemple. En la figura podem veure la formació de la molècula dhidrogen. Al superposar-se els orbitals, la densitat electrònica es concentra entre els nuclis. Com que ambdós electrons són atrets simultàniament pels nuclis, mantenen units als àtoms i es forma un enllaç covalent. Un altre exemple pot ser la molècula HCl. Tots els orbitals de valència del clor estan plens amb excepció de lorbital 3p que conté un sol electró. Aquest electró saparella amb lúnic electró de lhidrogen per formar lenllaç. A la figura es pot veure la superposició de lorbital 1s de lhidrogen amb el 3p del clor. Anàlogament es pot descriure la molècula de clor com a superposició dels orbitals 3p de tots dos àtoms.
41.1.2
Geometria MolecularEl model més senzill que explica la geometria de les molècules és el model de Repulsió del Parell Electrònic del Nivell de València (RPENV). Hem vist en les molècules diatòmiques que els àtoms suneixen entre si compartint parells delectrons del nivell de valència. En una molècula els parells delectrons es repel·leixen entre si. Per tant la geometria duna molècula correspondrà a la que minimitzi la repulsió entre els parells delectrons, és a dir, la geometria duna molècula correspondrà a la que permeti minimitzar lenergia potencial dels electrons i per tant de la molècula. Per tant depenent del nombre de parells delectrons les molècules adoptaran geometries diferents tal i com veiem a la figura.
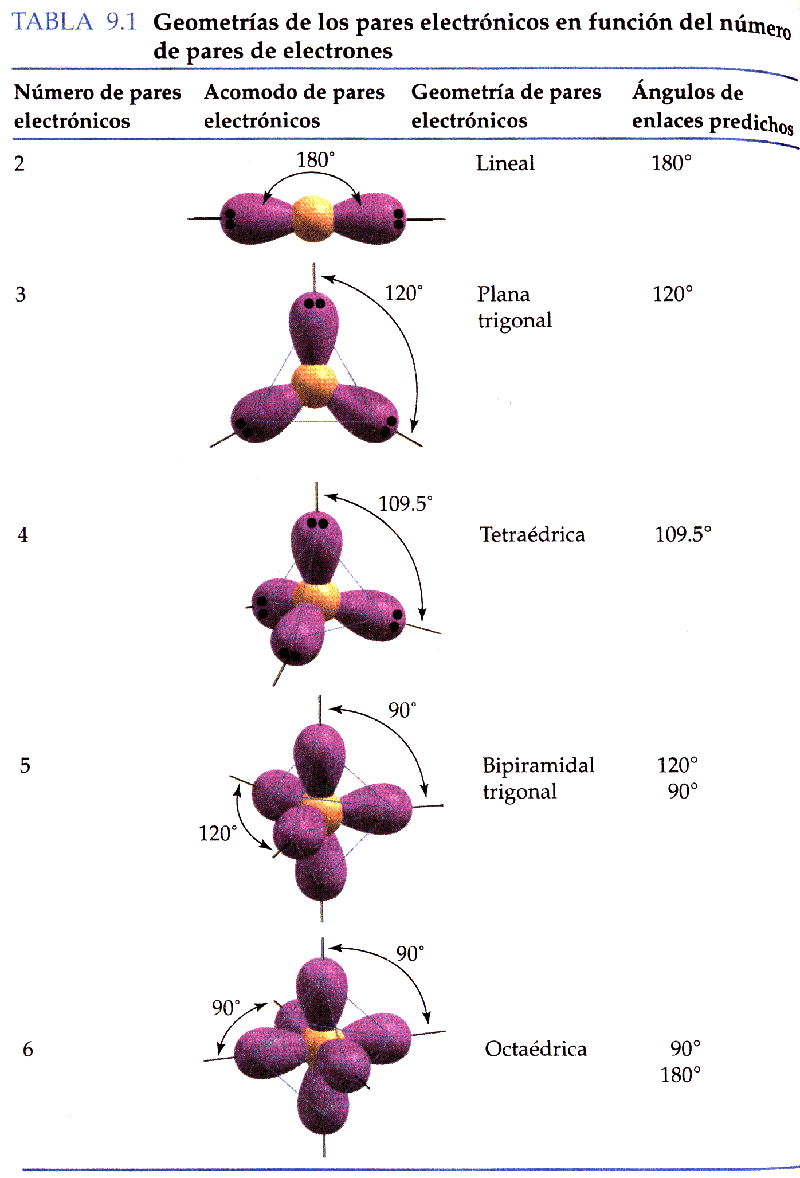
Quan en una molècula hi ha parells delectrons no enllaçants o enllaços múltiples sobserven petites desviacions en els angles denllaç que hem comentat abans. Els parells delectrons enllaçants són atrets pels dos nuclis dels àtoms enllaçats. En canvi, lúnica influència sobre el moviment dels electrons no enllaçants és latracció dun sol nucli i per tant ocupen una extensió major en lespai. El resultat és que els parells delectrons no enllaçants exerceixen forces de repulsió més intenses sobre els parells delectrons adjacents i per aquest motiu tendeixen a comprimir els angles que hi ha entre els parells enllaçants, de manera que lenergia sigui mínima.
Anem ara a veure com es construeixen els orbitals denllaç a partir dels orbitals atòmics per tal de poder explicar la geometria de les molècules. Per a aquest motiu cal introduir el concepte dorbital híbrid. Un orbital atòmic híbrid és el resultat duna combinació lineal de dos o més orbitals atòmics.
Híbrids sp. Geometria Lineal
: Si es suma un orbital s i un p resulta una nova funció híbrida. Si restem obtenim una segona funció híbrida. Aquestes funcions híbrides sanomenen orbitals híbrids sp i són equivalents llevat en un gir de 180º. Amb aquests orbitals és fàcil dexplicar lenllaç de molècules lineals, tipus HgCl2, BeF2Híbrids sp2. Geometria Trigonal Plana:
Hi ha tres maneres possibles de combinar un orbital s i dos orbitals p per produir tres orbitals híbrids equivalents sp2. Els tres orbitals híbrids són idèntics en tot llevat de lorientació, doncs presenten un gir de 120º entre ells. Amb aquests orbitals es descriuen molècules amb geometria trigonal plana, com ara BF3, BCl3, B(CH)3.Híbrids sp3. Geometria Tetraèdrica:
Hi ha quatre maneres independents de combinar un orbital s amb tres orbitals p per produir 4 nous orbitals híbrids equivalents sp3. Cada orbital híbrid sp3 es dirigeix cap al vèrtex dun tetraedre regular. Aquests híbrids permeten descriure molècules com ara CH3Cl, CF4, CH4, NH4+, BH4-.Híbrids dsp3. Geometria Bipiramidal Trigonal.
La combinació dun orbitalHíbrids d2sp3. Geometria Octaèdrica:
La combinació de dos orbitals d, un s i tres p dona lloc a 6 orbitals híbrids equivalents dirigits cap al vèrtex dun octaedre regular. Permet descriure molècules com ara el SF6.Els orbitals híbrids estan formats per lòbuls que sestenen a major distància del nucli que els propis orbitals atòmics a partir dels quals es formen. Això fa que siguin capaços de superposar-se amb orbitals daltres àtoms de manera molt més efectiva. Per tant els enllaços formats per orbitals híbrids tindran energies més baixes, és a dir, seran més forts que els enllaços formats per simples orbitals atòmics.
41.1.3
Polaritat de lenllaçPer descriure la polaritat de lenllaç és necessari treballar amb un tractament més rigorós de lenllaç covalent. És possible aconseguir una descripció matemàtica relativament senzilla i aproximada considerant que els Orbitals Moleculars es poden escriure com Combinació Lineal dOrbitals Atòmics. Això significa que per obtenir la funció dona dun orbital molecular es considera la combinació lineal (sumant o restant) de la funció dona de lorbital atòmic dun àtom a amb la funció dona de lorbital atòmic dun altre àtom b. Comencem suposant que els dos àtoms són dhidrogen:
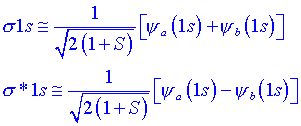
Els factors ![]() són factors de normalització; S és la integral de superposició:
són factors de normalització; S és la integral de superposició:
![]()
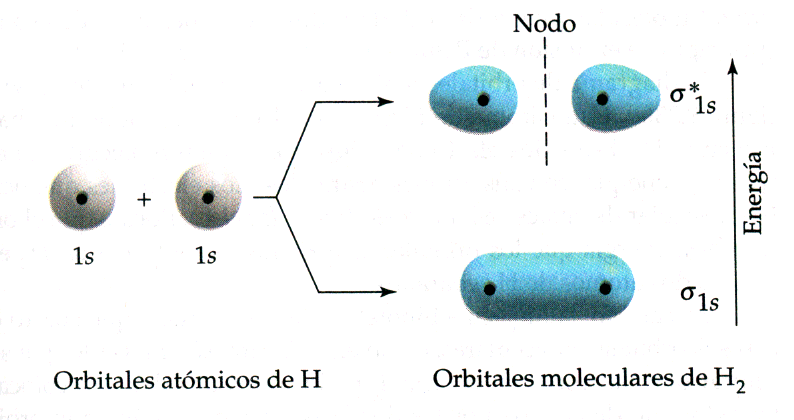
Quan es sumen les dos funcions 1s, es reforcen en tot lloc, però més notablement en la regió compresa entre els dos nuclis, cosa que contribueix a minimitzar lenergia potencial coulòmbica. Per tant aquest orbital té caràcter enllaçant i es denota per s 1s. Quan es resten, apareix un pla nodal entre els dos nuclis i la funció ondulatòria és de signe oposat a les dues bandes del pla. A la regió internuclear es produeix un dèficit de probabilitat que contribueix a elevar lenergia potencial del sistema i el node produeix un augment de lenergia cinètica de lelectró. En conseqüència lenergia total és elevada i per tant lorbital resultant és antienllaçant. Aquest orbital es denota com s *1s.
Resumint, la combinació lineal de dos orbitals atòmics produirà dos orbitals moleculars, un denergia més alta i un denergia més baixa que la dels orbitals atòmics. Si lorbital molecular té un node entre els nuclis serà antienllaçant i si hi ha un augment de la densitat de probabilitat entre els nuclis lorbital serà enllaçant.
Anàlogament es pot considerar la combinació lineal daltres orbitals atòmics. Per exemple, en les molècules diatòmiques homonuclears del segon període, els orbitals 1s daquests àtoms són molt propers al nucli, tenen una energia molt baixa i per tant amb prou feines són afectats pel fet que làtom estigui lliure o enllaçat químicament. Per tant aquests electrons es consideren no enllaçants. Cal aleshores considerar els orbitals moleculars que sobtenen a partir de la combinació lineal dorbitals 2s i 2p.
Per establir les aproximacions de la CLOA hem fet combinacions lineals dorbitals atòmics del mateix tipus, per poder conservar la simetria de la molècula
. Els orbitals moleculars de les molècules heteronuclears no són simètrics. Si la molècula diatòmica està formada per àtoms de nombres atòmics similars, com ara el CO, NO i CN, la asimetria no és pronunciada i es pot descriure satisfactòriament lestructura electrònica en termes dorbitals moleculars semblants als que sutilitzen per descriure les molècules diatòmiques homonuclears.Considerem la molècula de BN. Podem formar orbitals s 2s i s *2s a partir dels orbitals 2s dels dos àtoms. Com que el nitrogen té més càrrega nuclear, lorbital atòmic 2s daquest nucli és de menor energia que lorbital 2s del nucli de bor. En conseqüència, esperem que lorbital de més baixa energia, o orbital enllaçant s format per aquesta combinació estarà principalment concentrat prop de làtom de nitrogen, ja que aquesta és la regió de més baixa energia potencial. Aquesta asimetria es pot produir sumant els orbitals amb els coeficients adequats:
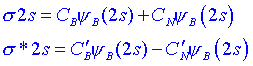
on CN > CB. El corresponent orbital antienllaçant ha de tenir un node entre els nuclis i ser de més alta energia, per tant esperem que lorbital antienllaçant estigui concentrat prop del nucli de bor majoritàriament. Per tant CB > CN. Amb la resta dorbitals moleculars ocorre el mateix.
Quan la diferència entre els nombres atòmics és gran els orbitals moleculars es formen per la combinació dels orbitals denergia similar. Un exemple és la molècula de HF. Lenergia de lorbital 1s de lhidrogen i lenergia dels orbitals 2p del fluor són prou similars i donen lloc a un parell dorbitals enllaçant-antienllaçant. Els orbitals 2px i 2py del fluor queden com orbitals atòmics no enllaçants. Com lorbital 2p del fluor té una energia inferior al 1s de lhidrogen, sespera que el parell delectrons de lorbital enllaçant s de HF estigui més temps prop del nucli de fluor i que en conseqüència la molècula del HF ha de ser polar, tal i com sobserva.
Un exemple de compartició extremadament desigual és la molècula gasosa de florur de liti LiF. En aquest cas es genera un parell dorbitals s -s * a partir de lorbital 2s del Li i un orbital 2p del fluor. Com que lenergia de lorbital 2p és molt inferior a la del 2s el parell delectrons de lorbital enllaçant roman quasi tot el temps prop de làtom de fluor. Com que el LiF és una molècula tan polar es diu que lenllaç és iònic,, i que el Liti ha cedit un electró al fluor. Lenllaç iònic sentén, doncs com un cas extrem de lenllaç covalent polar.
Per tant, el fet que els electrons tendeixin a distribuir-se al voltant de les zones on lenergia potencial és mínima, fa que els enllaços heteronuclears siguin en major o menor mesura enllaços covalents polars. En lapartat següent sestableix una magnitud anomenada electronegativitat que ens permetrà predir qualitativament la polaritat dels enllaços.
41.2
Classificació dels enllaços segons lelectronegativitat dels àtoms que el formenEs diu que un element és electronegatiu quan en les seves interaccions químiques té més tendència a adquirir electrons que a perdre'ls. Lelectronegativitat descriu, doncs latracció que exerceix un àtom sobre els electrons denllaç. S'han fet diversos intents per crear una escala quantitativa d'electronegativitat.
El procediment més senzill potser fos el de R.S.Mulliken, que suggerí que l'electronegativitat és proporcional al promig de l'energia d'ionització i l'afinitat electrònica.
La més usual és la de Pauling. Pauling va obtenir valors delectronegativitat comparant lenergia denllaç entre àtoms desiguals, AB, amb les energies mitjanes dels enllaços de A2 i B2. Si, per exemple, HF formés un enllaç covalent, seria desperar que lenergia denllaç HF fos pròxima al promig (mitjana aritmètica o geomètrica) de les energies denllaç de H2 i F2. El que passa, però, és que en molècules com HF els enllaços són més forts que els predits a partir dels promitjos. Lenergia denllaç del HF és de 565kJ/mol, mentre que les energies denllaç de H2 i F2 són 432 i 139 kJ/mol, respectivament. La mitjana geomètrica és de 245kJ/mol, que és molt menor que lenergia denllaç observada en el HF. Aquesta energia denllaç extra D duna molècula AB se suposa que és una conseqüència del caràcter iònic parcial de lenllaç, deguda a la diferència delectronegativitats entre els dos elements. La diferència delectronegativitats entre els àtoms A i B es pot definir com:
![]()
on DAB, DAA i DBB són les energies d'enllaç de les molècules diatòmiques corresponents. La rel quadrada sutilitza perquè proporciona un conjunt de valors delectronegativitat més consistent. Com que en aquesta equació només sobtenen diferències, sha dassignar a un àtom un valor específic delectronegativitat i aleshores es poden calcular fàcilment els valors per als altres àtoms. Al fluor, lelement més electronegatiu se li assigna un valor de 3,98.
Lelectronegativitat és una mesura de latracció que exerceix un àtom pels electrons denllaç que ha format amb un altra àtom. Els electrons denllaç de la molècula HF són arrossegats cap a làtom F, degut a la seva major electronegativitat. Lenllaç HF té caràcter iònic parcial. La diferència de les electronegativitats dels elements que formen part d'una molècula té relació directa doncs amb els moments dipolars, el tipus d'enllaç i l'energia d'enllaç.
Una diferència de més de 2,0 dona com a resultat un enllaç que es pot considerar iònic; una diferència en linterval 0,4-2,0 dona com a resultat un enllaç covalent amb caràcter iònic o enllaç covalent polar. Una diferència menor de 0,4 dóna com a resultat un enllaç que pot ser considerat com a covalent.
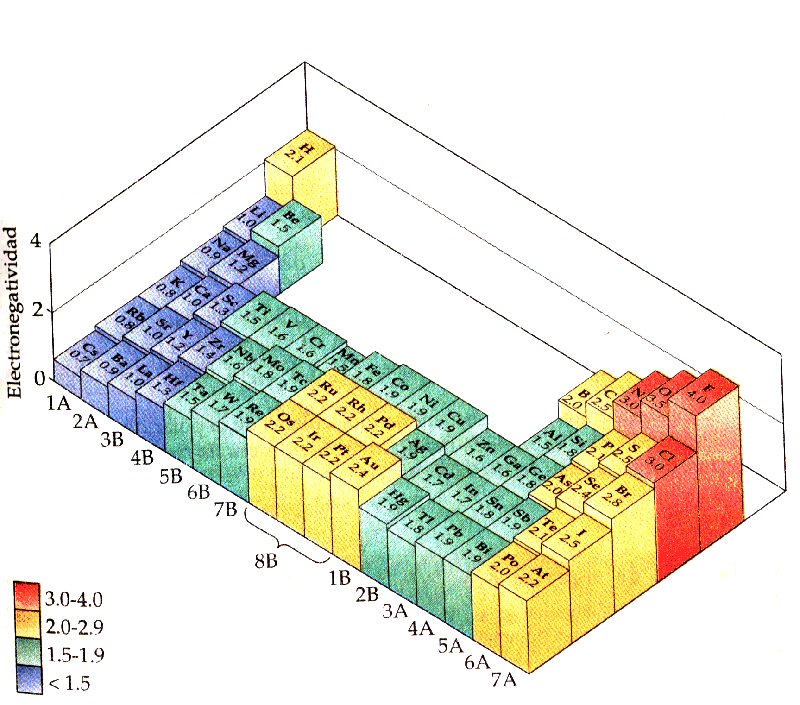
Veient aquesta taula s'observa que l'aptitud per atreure i mantenir electrons augmenta d'esquerra a dreta al llarg de qualsevol fila i de la part inferior a la superior en qualsevol columna de la taula periòdica. Això és consistent amb les tendències de lenergia dionització i de lafinitat electrònica.
41.3
Lenllaç iònic. Consideracions energètiquesLenllaç iònic es produeix quan hi ha una transferència delectrons entre àtoms o molècules, resultant-ne espècies químiques amb càrrega elèctrica ben definida que sanomenen ions i que quedaran unides per interacció electrostàtica. Per tant estarem parlant dun tipus denllaç fort i adireccional. Les forces electrostàtiques obliguen als ions a formar estructures que maximitzin les forces datracció i minimitzin les forces de repulsió, és a dir, a formar estructures que minimitzin lenergia potencial electrostàtica. Aquestes estructures són altament ordenades i corresponen a ordenaments geomètrics infinits anomenats cristalls.
En el model de lenllaç iònic imaginem les partícules enllaçades com si fossin entitats esfèriques que tenen una càrrega neta positiva o negativa. Una distribució esfèrica de càrrega es comporta com si la càrrega neta estigués concentrada en al centre de lesfera. Per tant la major simplificació del model de lenllaç iònic és que podem calcular les forces electrostàtiques que actuen entre els ions utilitzant la llei de Coulomb, com si els ions fossin càrregues puntuals. Aquest enfoc no és exacte (però permet calcular correctament els ordres de magnitud) i haurà de ser refinat.
Les estructures dels sòlids cristal·lins són aquelles que permeten el contacte més íntim entre els ions, per tal de maximitzar les forces datracció i aconseguir la mínima energia possible.
Per tant resulta interessant considerar la manera en què esferes de la mateixa grandària es poden disposar de la manera més eficient possible, és a dir, deixant el mínim espai lliure possible. Hi ha dues maneres, anomenades empaquetament hexagonal compacte i empaquetament cúbic compacte. En aquests empaquetaments existeixen tres tipus despais buits anomenats llocs triangulars, els llocs tetraèdrics i els llocs octaèdrics, depenent del nombre i disposició de les esferes al voltant dels espais buits. Les estructures cristal·lines de molts compostos binaris dels tipus AB, AB2 i A2B estan relacionades de manera senzilla amb les estructures dempaquetament compacte. Amb molta freqüència, lió B es pot representar mitjançant esferes amb una estructura dempaquetament compacte mentre que lió A ocupa els intersticis o espais buits entre les esferes de B.La relació de radis entre els ions A i B determina, no la grandària màxima que sha destablir per a que els ions més petits càpiguen en els llocs buits, si no que determina a partir de quin radi shi col·loquen. Això és així en la majoria dels casos, perquè daquesta manera els ions grans amb càrregues idèntiques shan de separar (disminuint les repulsions) per permetre la cabuda dels ions petits. Daltra banda lapropament entre els ions de diferent càrrega és màxim (maximitzant les forces datracció). La relació entre els radis dels ions, doncs determina el nombre màxim de coordinació o nombre de veïns immediats que poden agrupar-se al voltant dun ió central per tal daconseguir que lenergia del cristall sigui mínima.
41.3.1
Càlcul de lenergia de la xarxa cristal·linaComencem amb la reacció de formació del NaCl cristal·lí a partir dels elements:
![]()
Aquest és un procés molt complex. Fixem-nos en el següent gràfic:
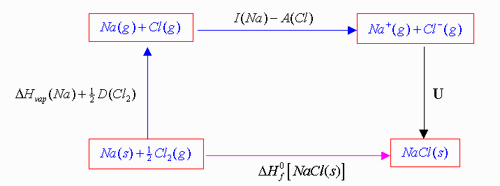
El canvi dentalpia per la ruta directa és el calor de formació del NaCl(s):
![]()
Veiem que el procés de formació es pot desglossar en tres etapes:
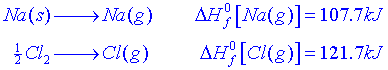
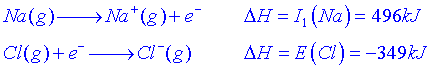
![]()
Lenergia de la xarxa no es pot calcular directament, però és possible utilitzar la llei de Hess per sumar cada pas de tal manera que obtinguem lenergia de la xarxa; al fer això estem construint el que sanomena com un cicle Born-Haber.
La suma de tots els passos del camí indirecte ha de ser equivalent al camí directe i per tant:
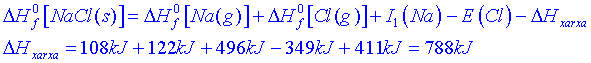
O sigui que lenergia de la xarxa del clorur de sodi és de 788 kJ/mol.
41.3.2
Formació de lenllaç iònicExaminarem ara la formació del clorur de sodi a partir dels àtoms en estat gasós. Daquesta manera ens centrarem únicament en els factors energètics que influeixen en la formació de lenllaç iònic: no ens haurem de preocupar per lenllaç del sodi metàl·lic o del clor molecular. Imaginarem aleshores que el cristall es forma en tres etapes: la primera la formació dels ions gasosos a partir dels àtoms; la segona la formació de molècules diatòmiques gasoses a partir dels ions, i tercera la formació del cristall iònic.
En el primer pas, cal subministrar 118kcal/mol als àtoms de sodi per a ionitzar-los, mentre que els àtoms de clor desprenen 83,4 kcal/mol en absorbir un electró. Per tant per formar els ions a partir dels àtoms calen 35kcal/mol de parells iònics. Per tant, si el sodi i el clor lúnica cosa que fan és formar octets complerts es requereix energia. Així doncs els àtoms no tenen cap impuls natural a arribar a una estructura doctets. Cal una altra raó per a justificar la formació de lenllaç.
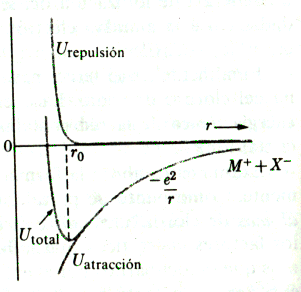
Ara considerem la formació de la molècula gasosa a partir dels ions. Lenergia potencial disminueix conforme els ions sapropen. Quan els dos ions són molt a prop, els electrons exteriors comencen a ocupar el mateix espai i es desenvolupa una potent força de repulsió, que es tradueix en un augment de lenergia potencial. La distància r0 a la qual lenergia potencial és mínima és la distància denllaç. Per la forma de la corba de lenergia potencial podem veure que lenergia potencial a r0 és quasi igual a la contribució deguda a latracció únicament. Experimentalment sha trobat que r0=2,38 . Lenergia denllaç és molt aproximadament de 139,3kcal/mol (-q2/4p e 0r0 ). Així doncs, lenergia que sallibera quan es formen aquestes molècules a partir dels àtoms gasosos és de 35,0-139,3 = -104,3 kcal/mol. Per tant lenergia del sodi i del clor iònicament enllaçats és més baixa que la dels àtoms separats. Per tant, lenergia necessària per formar els ions és més que compensada per lenergia deguda a latracció coulòmbica.
Anem ara a centrar-nos en la formació del cristall iònic. Per fer-ho senzill, calcularem primer lenergia dun ió sodi dun cristall unidimensional, és a dir una filera on salternen ions clor i ions sodi separats per una distància r0.
Aleshores:
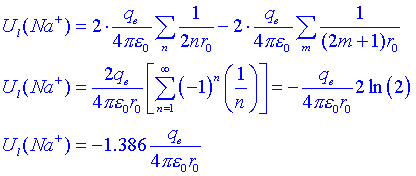
Per tant, fixem-nos que lenergia de lió sodi és més baixa en aquest cristall unidimensional que en la molècula diatòmica. De manera semblant podríem seguir sumant totes les altres fileres que tindríem en un cristall tridimensional real. Per a qualsevol xarxa cristal·lina, lenergia es pot escriure com:
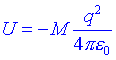
on M sanomena constant de Madelung. Per una xarxa cúbica com la del clorur de sodi M=1.75, és a dir, lenergia dun ió sodi en una xarxa cúbica és un 75% més baixa que en la corresponent molècula diatòmica. Aquesta disminució addicional és deguda a que en el cristall lió sodi es troba enllaçat amb tots els ions clorur del cristall. La separació dels ions en el cristall de clorur de sodi és de 2,80 , una mica més gran que en la molècula diatòmica. Aleshores U=-207kcal/mol.
Fins ara hem tingut en compte només lenergia deguda a forces coulòmbiques entre ions considerats com a càrregues puntuals. Degut a la grandària finita del núvol electrònic al voltant de cada ió, existeixen forces repulsives entre ions veïns que no hem inclòs en el càlcul. Lefecte daquestes repulsions és fer que lenergia real de la xarxa cristal·lina prop dun 10% menys negativa que el valor donat per les forces coulòmbiques soles. Daquesta manera, la veritable energia de la xarxa cristal·lina del clorur de sodi és de -183 kcal/mol. La comparació daquest número amb lenergia de la molècula diatòmica 139,5kcal/mol, deixa clar que el cristall és molt més estable i per aquest motiu a temperatura ambient la pressió de vapor és molt baixa.
Lenergia que sallibera quan es forma la xarxa cristal·lina del clorur de sodi és finalment de 35-183 = -148 kcal/mol. Per tant podem dir que el clorur de sodi cristal·lí és més estable que els àtoms gasosos i que lorigen daquesta estabilitat és latracció coulòmbica dels ions de la xarxa cristal·lina.
Anem a veure ara com calcular lenergia iònica de la xarxa cristal·lina quan es pren en consideració la repulsió entre els ions veïns. La repulsió és deguda a la grandària finita dels ions i és de la mateixa naturalesa que les repulsions de Van der Waals entre àtoms neutres. Lexpressió refinada de lenergia potencial és:
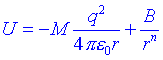
El terme B/rn representa a les repulsions dels àtoms veïns i el valor de n oscil·la entre 9 i 12, segons el tipus de cristall. Generalment es pot avaluar n a partir de la compressibilitat del cristall. El coeficient B mesura la potència de les forces repulsives i és diferent per ions diferents. B es pot eliminar de lexpressió si coneixem el valor de r per al que el cristall és estable, doncs aleshores U és un mínim:
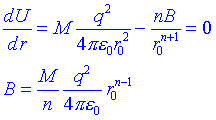
Substituint B a lexpressió de lenergia:
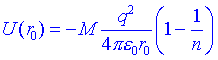
Com que n és aproximadament 10, veiem que lenergia de la xarxa cristal·lina és a prop dun 10% inferior a lenergia deguda únicament a la interacció coulòmbica. En general hi ha una concordança molt satisfactòria entre els valors calculats i mesurats de la xarxa cristal·lina dels halogenurs dels metalls alcalins.
Lenergia de la xarxa cristal·lina augmenta amb el producte de les càrregues dels dos àtoms. Això suggereix que, en els compostos iònics cada àtom ha de tractar dassolir una càrrega tant gran com sigui possible. Aquesta tendència està limitada pels valors creixents de les successives energies dionització dels àtoms. Així doncs, la màxima càrrega positiva està limitada pel nombre delectrons de valència i la càrrega màxima negativa està limitada pel nombre de vacants que hi ha en els orbitals de valència de més baixa energia. Normalment lenergia de la xarxa no sòl compensar la formació dions amb càrregues majors de ± 3.
41.3.3
Efectes de la grandària dels ions sobre el nombre de coordinació, lestructura cristal·lina i sobre lenergiaEs poden utilitzar els radis iònics per comprendre, per exemple, les variacions en les energies de la xarxa cristal·lina dels halogenurs alcalins. Per qualsevol ió positiu donat, lenergia de la xarxa cristal·lina es fa més petita a mesura que lió negatiu es fa més gran. La mateixa tendència es troba si sexaminen els compostos dun ió negatiu qualsevol: lenergia de la xarxa cristal·lina disminueix a mesura que augmenta la grandària de lió positiu. Això és lògic si pensem que lenergia de la xarxa cristal·lina depèn de 1/(r++r-).
Podríem suposar que laugment del nombre de coordinació hauria daugmentar lestabilitat de la xarxa. En el clorur de cesi, el nombre de coordinació és 8, la constant de Madelung és de 1,763, mentre que pel clorur de sodi, amb nombre de coordinació 6 és 1,748. Daquesta manera, amb les mateixes distàncies internuclears, la xarxa cristal·lina del clorur de cesi és un 1% més estable que la del clorur de sodi.
La majoria dels halogenurs però, cristal·litzen en lestructura de coordinació 6 del clorur de sodi. Això és degut a que quan sintenta empaquetar 8 ions grans negatius al voltant dun petit ió positiu central, es troba que la distància de major apropament entre els ions positius i negatius no és determinada per r++r-, sinó pel radi de lió negatiu sol. Degut a la grandària, 8 ions negatius es tocaran lun amb laltra sense que cap dells quedi molt a prop de lió positiu. En aquesta situació lenergia de la xarxa cristal·lina no és tant gran com seria possible, ja que la distància entre els ions positius i negatius no és tant petita com r++r- i a més les forces de repulsió entre els ions negatius tan propers seran grans. Si es posen menys ions negatius al voltant de lió positiu aleshores lapropament amb els ions negatius és més gran. A més, la distància entre els ions negatius és més gran, disminuint així les repulsions. Daquesta manera, quan la diferència de grandàries entre els ions és prou gran, el nombre de coordinació acostuma a ser 6. Quan els ions són de grandàries semblants, com per exemple el CsCl, CsBr i CsI, els ions poden gaudir de lestabilitat lleugerament major de la coordinació 8.
Per tant, generalment els ions es disposen de tal manera que puguin estar en contacte amb ions de càrrega contrària i de manera que els ions amb càrregues iguals quedin relativament allunyats per tal de minimitzar lenergia potencial.
41.4
Energies denllaç. Consideracions TermodinàmiquesAnem a veure com es calculen les energies associades als enllaços.
41.4.1
Energies d'enllaç en substàncies covalentsLa variació d'energia en una reacció química és deguda fonamentalment a la ruptura i formació de nous enllaços químics. L'energia d'aquests enllaços es determina generalment a partir del següent cicle:
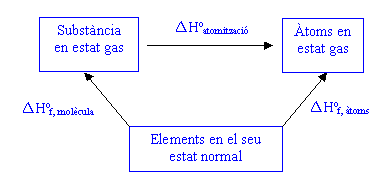
Aleshores:
![]()
L'energia de trencament dels enllaços es determina amb els reactius i productes en estat gas, per què d'aquesta manera els canvis energètics són deguts únicament al trencament d'enllaços, no hi ha cap contribució a l'energia necessària per separar les molècules.
El valor exacte de l'energia d'enllaç entre dos àtoms en particular depèn de la molècula en la que es troben, però aquesta dependència és relativament petita, cosa que suggereix que els factors principals que determinen lenergia dun enllaç particular són les propietats intrínseques dels dos àtoms enllaçats i només en menor grau, les propietats de lambient proporcionat per la resta dàtoms de la molècula.
És útil doncs, calcular un valor promig de l'energia de cada enllaç i tabular-lo. En concret es tabula l'energia mitjana necessària per trencar un mol d'enllaços. D'aquesta manera és possible fer una bona estimació de l'entalpia d'una reacció a partir de les energies d'enllaç:
![]()
41.4.2
Energies reticularsAnàlogament, també resulta útil conèixer l'energia necessària per formar un cristall iònic a partir dels ions en estat gas. Aquesta magnitud s'anomena energia reticular. L'energia reticular no es pot avaluar directament, si no a través del cicle de Born-Haber.
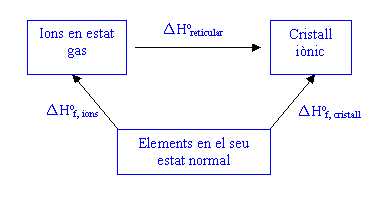
Per tant aleshores:
![]()
Si volem calcular l'energia reticular, fixem-nos en què:
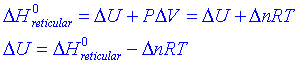
on D n seran els mols de gas desapareguts, i per tant serà un nombre negatiu. El que interessa tabular però és D Hºreticular a partir de les quals calcularem els calors de reacció quan intervenen substàncies iòniques.
41.5
Estudi del tipus denllaç segons les propietats de les substàncies.
41.5.1
Substàncies IòniquesEn molts casos es pot saber si un compost és iònic si coneixem la seva composició. En general els cations són ions metàl·lics i els anions són ions no metàl·lics. Per tant, els compostos iònics generalment són combinacions de metalls i no metalls.
41.5.2
Substàncies CovalentsEs distingeix entre les substàncies moleculars, formades per molècules discretes que interactuen mitjançant forces de Van der Waals, i sòlids de xarxa covalent.
Sòlids moleculars
Els sòlids moleculars consisteixen en molècules (típicament formades per no metalls units amb enllaços covalents) unides per forces intermoleculars: forces dipol-dipol, forces de dispersió de London i ponts d'hidrogen. Com que aquestes forces són dèbils, els sòlids moleculars són tous i tenen punts de fusió relativament baixos (generalment menys de 200ºC). Quasi totes les substàncies que són gasos o líquids a temperatura ambient formen sòlids moleculars a temperatures baixes, com per exemple Ar, CH4, H2O i CO2.
Els sòlids moleculars acostumen a tenir una conductivitat tèrmica molt baixa i en estat pur no són conductors de l'electricitat. Els sòlids moleculars poden ser amorfs (com el vidre), cristal·lins (com el gel) o part amorf part cristal·lí (HDPE).
L'energia d'enllaç dels cristalls moleculars és molt petita comparada amb cristalls iònics o cristalls amb enllaç covalent. Aquests tipus de cristalls tendeixen a ser volàtils i posseeixen punts de fusió i d'ebullició baixos. Els cristalls moleculars tendeixen a ser tous, compressibles i fàcilment deformables. Són, en general, bons aïllants de l'electricitat. Les molècules no tenen càrrega elèctrica neta i per tant no poden transportar electricitat. A més, com que el cristall es composa de molècules discretes, els electrons tendeixen a estar localitzats al voltant d'un grup específic de nuclis. Exemples: H2O, CO2, I2, naftalina, etc.
Sòlids de Xarxa Covalent
Els sòlids de xarxa covalent consisteixen en àtoms units en grans xarxes o cadenes mitjançant enllaços covalents. Com que els enllaços covalents són molt més forts que les forces intermoleculars, aquests sòlids generalment són molt més durs i tenen punts de fusió més elevats que els sòlids moleculars. Exemples típics en són el diamant, el carbur de silici SiC i el nitrur de bor BN. Els cristalls covalents són mals conductors de lelectricitat degut a que els electrons en el sòlid estan localitzats en els enllaços covalents i no tenen llibertat de moures dins del cristall.
En el diamant cada àtom de carboni està unit a quatre àtoms de carboni formant una matriu tridimensional interconnectada d'enllaços senzills carboni-carboni. El punt de fusió del diamant és de 3550ºC.
En el grafit els àtoms de carboni estan disposats en capes danells hexagonals interconnectats. Cada àtom de carboni està unit a daltres tres de la capa; la longitud de lenllaç és de 1.42 . Els orbitals p formen enllaços moleculars p deslocalitzats i això fa que el grafit sigui conductor de lelectricitat. Les capes estan separades una distància de 3.41 i es mantenen unides per forces de dispersió. Les capes llisquen fàcilment les unes sobre les altres, cosa que fa apte al grafit per a ser utilitzat com a lubricant i per les mines dels llapis.